
����Ŀ��ʵ����������CoCl2��6H2OΪԭ����ȡ���Ȼ���������[Co(NH3)6Cl3]��ʵ�鲽�����£�
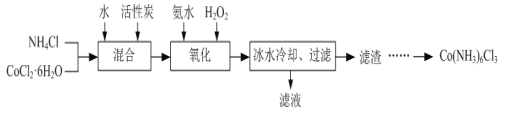
��֪����Co(NH3)6Cl3�ڲ�ͬ�¶���ˮ�е��ܽ��������ͼ��
����Co(NH3)6Cl3��Һ�м���һ�������������ڽᾧ��
��Ksp[Co(OH)2]=1.09��10-15��Ksp[Co(OH)3]=2��10-44��
��1����ʵ�������NH4Cl������Ӧ���⣬���ɷ�ֹ�ڵμӰ�ˮʱc(OH-)������ԭ����______��
��2�����������м��백ˮ��H2O2����Һ������Co(NH3)6Cl3��
������ʱ���ȼ��백ˮ�ټ���H2O2����ԭ����______��
�ڸ÷�Ӧ�Ļ�ѧ����ʽΪ______��
�۷�Ӧʱ��Ҫ���Ʒ�Ӧ�¶���50 ��~60 ��֮�䣬�ɲ�ȡ�ļ��ȷ�ʽ��______��
��3����ˮ��ȴ��Ŀ����______��
��4���벹�������ɹ��˺�����������ȡCo(NH3)6Cl3��ʵ�鷽���������������ˮ�У���ֽ��裬______�����¸����ʵ������ʹ�õ��Լ������ᡢ�Ҵ���
���𰸡�NH4Cl����ˮ�����NH4+������NH3��H2O�ĵ����ֹCo(OH)3������H2O2+ 2CoCl2+2NH4Cl+10NH3��H2O��2Co(NH3)6Cl3+ 12H2O��H2O2+ 2CoCl2+2NH4Cl+10NH3��2Co(NH3)6Cl3+ 2H2Oˮԡ���Ƚ������Ȼ��������ܵ��ܽ�ȣ���߲������ȹ��ˣ�����Һ�м����������ᣬ�ñ�ˮԡ��ȴ����ˣ����������Ҵ�ϴ��
��������
��1���ڼ������������������������ܳ��������ԭ��NH4Cl����Ҫ���ó����ṩNH3���⣬NH4Cl����ˮ�����NH4+������NH3H2O�ĵ��룬������Һ�ļ��ԣ��ʴ�Ϊ��NH4Cl����ˮ�����NH4+������NH3H2O�ĵ��룻��2��������ʱ���ȼ��백ˮ�ټ���H2O2�����ȼӹ������⣬��+2����������+3�ۣ��ټ��백ˮ������Co(OH)3�����ɣ������ڲ�������ɣ��ʴ�Ϊ����ֹCo(OH)3�����ɣ������������м��백ˮ��H2O2����Һ������Co(NH3)6Cl3�ķ�Ӧ��Ϊ��H2O2+2CoCl2+2NH4Cl+10NH3H2O=2Co(NH3)6Cl3+12H2O��H2O2+2CoCl2+2NH4Cl+10NH3=2Co��NH3��6Cl3+2H2O������ˮԡ���ȿ��Ʒ�Ӧ�¶���50�桫60��֮�䣻�ʴ�Ϊ��ˮԡ���ȣ���3����ͼ2��֪Co��NH3��6Cl3ˮ�е��ܽ�����¶ȵ����߶�������Ϊ�˽������Ȼ��������ܵ��ܽ�ȣ���߲�����Ӧ��ˮ��ȴ���ʴ�Ϊ���������Ȼ��������ܵ��ܽ�ȣ���߲�������4���ɹ��˺�����������ȡCo��NH3��6Cl3��ʵ�鷽���������������ˮ�У���ֽ��裬���ȹ��ˣ�����Һ�м�������Ũ���ᣬ�ñ�ˮԡ��ȴ����ˣ����������Ҵ�ϴ����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͨ�����з�ɢϵʱ���ܹ۲쵽�����ЧӦ���ǣ� ��
A.����B.Fe(OH)3����C.������ҺD.Na2SO4��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��pKa=-lgKa��25��ʱ��H2SO3�� pKa1=1��85��pKa2=7��19����0��1molL-1NaOH��Һ�ζ�20mL0��1molL-1H2SO3��Һ�ĵζ�������ͼ��ʾ(�����ϵ�����ΪpH)������˵������ȷ����( )
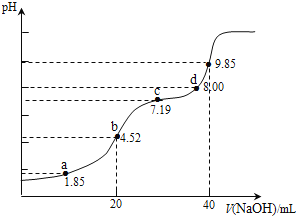
A��a��������Һ�У�2c(H2SO3)+c(SO32-)��0��1 molL-1
B��b��������Һ�У�c(H2SO3)+c(H+)=c(SO32-)+c(OH-)
C��c��������Һ�У�c(Na+)��3c(HSO3 )
D��d��������Һ�У�c(Na+)��c(SO32-)��c(HSO3-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ���Т�NO3-��HCO3-��SO32-��CO32-��SO42-�����������ӡ������м���������Na2O2�������Һ������Ũ�Ȼ������ֲ������(����Һ����ޱ仯) ( ).
A.��B.�٢ܢ�C.�٢ۢ�D.�٢ۢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijС����Ʋ�ͬʵ�鷽���Ƚ�Cu2+��Ag+ �������ԡ�
��1������1��ͨ���û���Ӧ�Ƚ�
���ữ��AgNO3��Һ����ͭ˿��������ɫ���壬��Һ��������Ӧ�����ӷ���ʽ��_______��˵��������Ag+��Cu2+��
��2������2��ͨ��Cu2+��Ag+ �ֱ���ͬһ���ʷ�Ӧ���бȽ�
ʵ�� | �Լ� | ��ż����� | |
�Թ� | �ι� | ||
| 1.0 mol/L KI��Һ | 1.0 mol/L AgNO3��Һ | ������ɫ��������Һ��ɫ |
1.0 mol/L CuSO4��Һ | ������ɫ����A����Һ��� | ||
�� �����飬������Һ����I2����ɫ������________��
�� �����飬������Һ��I2���Ʋ�Cu2+������������ɫ����A��CuI��ȷ��A��ʵ�����£�
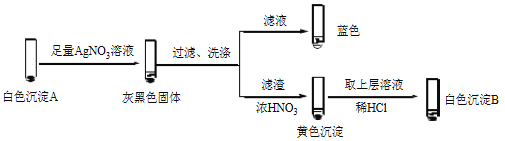
a��������Һ��I2����Һ����ɫ˵����Һ����________�������ӷ��ţ���
b����ɫ����B��________��
c����ɫ����A��AgNO3��Һ��Ӧ�����ӷ���ʽ��____��˵��������Ag+��Cu2+��
��3����������2��Ag+ δ������I- ����Cu2+������I-��ԭ�����ʵ�����£�
��� | ʵ��1 | ʵ��2 | ʵ��3 |
ʵ�� |
|
|
|
���� | �����Ա仯 | a����Һ�Ͽ���ػ�ɫ,b�е缫 ����������������ָ��ƫת | c����Һ������dz��ɫ�� ������ָ��ƫת |
���缫��Ϊʯī����ҺŨ�Ⱦ�Ϊ 1 mol/L��b��d����ҺpH��4��
�� a����Һ���ػ�ɫ��ԭ����_______���õ缫��Ӧʽ��ʾ����
�� ��ʵ��3������˵��Cu2+������I-�������ǿ����е�����Ҳ���������ã����ʵ��֤ʵ�˸����ݣ�ʵ�鷽����������_______��
�� ����2�У�Cu2+������I-,��Ag+δ������I-��ԭ��_______��
�����ϣ�Ag+ + I- = AgI�� K1 =1.2��1016��2Ag+ + 2I- = 2Ag��+ I2 K2 = 8.7��108��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��N2O�׳���Ц�������������������������������·�Ӧ�ܲ���N2O��3CO��2NO2![]() 3CO2��N2O�����й���N2O��˵����ȷ����(����)
3CO2��N2O�����й���N2O��˵����ȷ����(����)
A. ������Ӧ��ÿ����1 mol N2O��ת�Ƶĵ�����Ϊ3NA
B. �����ʵ�����N2O��CO2������ȵĵ�����
C. N2Oֻ���������ԣ���ԭ��
D. N2O��Ѹ��������Ѫ�쵰��ϣ�ʹ���ж�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ���������ʵ��װ��������֤SO2�����ʣ�ͨ������ʵ�飬���н��۱�������ȷ���ǣ� ��

A. a������ɫ����֤SO2����Ư����
B. b������ɫ����֤SO2�������������������
C. c������ɫ��ȥ����֤SO2���л�ԭ��
D. ֻ�����ռ���Һ����β��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ���ú��̷���(��Ҫ�ɷ�MnO2����������Fe2O3��Al2O3��CuO��CaO��)����������������ϴ������Ʊ�MnSO4���������£�
��֪��25��ʱ����������������ܶȻ�����(Ksp)���±���ʾ��
�������� | Al(OH)3 | Fe(OH)3 | Cu(OH)2 | Mn(OH)2 |
Ksp | 1.3��10-33 | 4.0��10-38 | 2.2��10-20 | 1.9��10-14 |
��ش�
��1������1�Ļ�ѧʽΪ__________________��
��2�������£�����pHΪ5����ͨ������˵����ʱAl3+��Fe3+�ѳ�����ȫ��������_________�� ��������ʱ������(NH4)2S������Ϊ___________________��
��3�����ữ����ԭ���У�����������������ԭ��Ӧ�����ӷ���ʽΪ__________________��
��4����֪����Һ3�г�MnSO4�⣬����������(NH4)2SO4��(NH4)2SO4��MnSO4���ܽ����������ͼ��ʾ���ݴ��жϣ�������I��ӦΪ����Ũ����____________��ϴ�ӡ����

��5����ҵ�Ͽ��õ������MnSO4��Һ�ķ����Ʊ�MnO2����������ӦʽΪ________________��
��6��25.35 g MnSO4��H2O��Ʒ���ȷֽ���̵���������(��Ʒ�������¶ȱ仯������)����ͼ��ʾ��1150��ʱ����Ӧ�Ļ�ѧ����ʽΪ___________________��
 ��
��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com