
【题目】某课外小组研究铝土矿中Al2O3的含量。查阅资料得知,铝土矿的主要成分是Al2O3,杂质是Fe2O3、SiO2等。从铝土矿中提取Al2O3的过程如下:

(1)第①步,向铝土矿中加入足量烧碱溶液,充分反应,发生反应的离子方程式是:______________ 、________________;
(2)第③步中,生成氢氧化铝的离子方程式是_____________。若往A溶液中通入足量CO2,产生的沉淀为____________________(填化学式);
(3)工业上制取AlCl3常用Al2O3与C、Cl2在高温条件下反应,已知每消耗0.5mol碳单质,转移1mol电子,则该反应的氧化产物为_____________(填化学式)。
【答案】Al2O3+2OH- +3H2O= 2[Al(OH)4]- 或 Al2O3+2OH-=2AlO2-+H2O SiO2+2OH-=SiO32-+H2O Al3++3NH3H2O=Al(OH)3↓+ 3NH4+ Al(OH)3、H2SiO3 CO
【解析】
(1)第①步,向铝土矿中加入足量烧碱溶液,只有Fe2O3不溶于氢氧化钠;氧化铝和氢氧化钠反应生成偏铝酸钠和水、二氧化硅与氢氧化钠反应生成硅酸钠和水;
(2)第③步是向氯化铝溶液中通入氨水生成氢氧化铝沉淀。A溶液中含有偏铝酸钠、硅酸钠,通入足量CO2,生成氢氧化铝沉淀、碳酸氢钠;
(3)根据碳元素的化合价变化判断氧化产物。
(1)第①步,向铝土矿中加入足量烧碱溶液,氧化铝和氢氧化钠反应生成偏铝酸钠和水,反应离子方程式是Al2O3+2OH-=2AlO2-+H2O;二氧化硅与氢氧化钠反应生成硅酸钠和水,反应离子方程式是SiO2+2OH-=SiO32-+H2O;
(2)第③步是向氯化铝溶液中通入氨水生成氢氧化铝沉淀,反应离子方程式是Al3++3NH3H2O=Al(OH)3↓+3NH4+。A溶液中含有偏铝酸钠、硅酸钠,通入足量CO2,偏铝酸钠与足量CO2反应生成氢氧化铝沉淀和碳酸氢钠,硅酸钠与足量CO2反应生成H2SiO3沉淀和碳酸氢钠,所以产生的沉淀为Al(OH)3、H2SiO3;
(3)Al2O3与C、Cl2在高温条件下反应生成AlCl3,每消耗0.5mol碳单质,转移1mol电子,说明碳的化合价由0升高为+2,所以另一种产物是CO,该反应的氧化产物为CO。


 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:
【题目】某温度下,溶液中由水电离出氢离子的浓度为1×10-12mol·L-1,下列说法正确的是( )
A. 该溶液pH=12B. 该溶液pH=2
C. 该溶液pH=12或2D. 不能确定溶液pH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,能达到实验目的的是:

A. 用图(a)所示装置除去氯气中含有的少量氯化氢
B. 用图(d)所示装置分离苯萃取碘水后已分层的有机层和水层
C. 用图(c)所示装置制取少量纯净的二氧化碳气体
D. 用图(b)所示装置蒸发氯化钠溶液制备氯化钠晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液含有①NO3-②HCO3-③SO32-④CO32-⑤SO42-等五种阴离子。向其中加入少量的Na2O2固体后,溶液中离子浓度基本保持不变的是(设溶液体积无变化) ( ).
A.①B.①④⑤C.①③⑤D.①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C是原子序数依次增大的短周期主族元素,三种元素原子序数之和为35,且C的原子序数是A的2倍。A、B、C三种元素的单质在适当条件下可发生如图所示的变化。下列说法正确的是

A. 甲、乙、丙三种物质的水溶液均显碱性
B. 甲是碱性氧化物,乙是酸性氧化物
C. 甲、乙可能都有漂白性,其漂白原理相同
D. 丙的水溶液在空气中长期放置,溶液可能会变浑浊
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O俗称“笑气”,曾用作可吸入性麻醉剂。以下反应能产生N2O:3CO+2NO2![]() 3CO2+N2O。下列关于N2O的说法正确的是( )
3CO2+N2O。下列关于N2O的说法正确的是( )
A. 上述反应中每生成1 mol N2O,转移的电子数为3NA
B. 等物质的量的N2O和CO2含有相等的电子数
C. N2O只具有氧化性,无还原性
D. N2O会迅速与人体血红蛋白结合,使人中毒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】建构数学模型来研究化学问题,既直观又简洁。下列建构的数轴模型正确的是
A. 钠在氧气中燃烧,钠的氧化产物: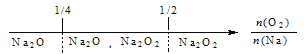
B. 铁在Cl2中燃烧,铁的氧化产物:![]()
C. NH3与Cl2反应,反应产物: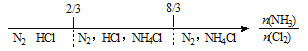
D. FeBr2溶液中通入Cl2,铁元素存在形式: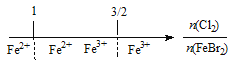
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若某电能与化学能的转化装置(电解池或原电池)中发生的总反应的离子方程式是 2Ag+2H+=2Ag++H2↑,则下列关于该装置的有关说法正确的是
A. 该装置可能是原电池,也可能是电解池
B. 该装置只能是原电池,且电解质溶液为硝酸
C. 该装置只能是电解池,且金属银为该电解池的阳极
D. 该装置只能是原电池,电解质溶液不可能是盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组用下列装置制取收集纯净的氯气,并研究其性质。请回答下列问题。

(1)装置甲中仪器A的名称是________,丙中应装的溶液是_______ ,甲装置中发生反应的离子方程式为_____________ 。制取收集纯净氯气的装置接口连接顺序是a→ …→g(补充完整)_________。
(2)制备反应会因盐酸浓度下降而停止,为测定反应残余液中盐酸的浓度,探究小组同学提出下列实验方案:
I方案:与足量AgNO3溶液反应,称量生成的AgCl质量。
Ⅱ方案:采用酸碱中和滴定法测定。
Ⅲ方案:与已知量CaCO3(过量)反应,称量剩余的CaCO3质量。
继而进行下列判断和实验:
①判定I方案不可行,理由是__________________;
②进行Ⅱ方案实验:准确量取残余清液稀释一定倍数后作为试样。
a.量取试样20.00mL于锥形瓶中,若锥形瓶中存有少量水,对实验结果是否有影响?_____填“是”或“否” )。用0.10 molL-1NaOH标准溶液滴定,消耗NaOH标准溶液的体积如图所示 ,其读数为 _____mL.

b.平行滴定后获得实验结果
③判断Ⅲ方案的实验结果___________(填“偏大”、“偏小”或“准确”)。[已知:Ksp(CaCO3)=2.8×10-9、Ksp(MnCO3)=2.3×10-11
(3) 某同学认为上述方案缺少尾气吸收装置,请在下面的方框中画出该装置并注明试剂____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com