
【题目】下表是在相同温度下,三种酸的一些数据,下列说法正确的是( )
酸 | HX | HY | HZ | ||
浓度(mol/L) | 0.12 | 0.2 | 0.9 | 1 | 1 |
电离度 | 0.25 | 0.2 | 0.1 | 0.3 | 0.5 |
电离常数 | K1 | K2 | K3 | K4 | K5 |
A.相同温度下,从HX的数据可以说明:弱电解质溶液浓度越低,电离度越大,且K1>K2>K3=0.1
B.室温时,若在NaZ溶液中加水,则 的比值变小,若加少量盐酸,则比值变大
的比值变小,若加少量盐酸,则比值变大
C.等物质的量的NaX、NaY和NaZ的混合,c(X-)+c(Y-)-2c(Z-)=2c(HZ)-c(HX)-c(HY),且c(Z-)<c(Y-)<c(X-)
D.相同温度下,K5>K4>K3
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种物质中均含有同一种非金属元素,它们能发生如图所示的转化关系,该元素(用R 表示)的单质能与NaOH溶液反应生成盐(Na2RO3)和氢气。

请回答下列问题:
(1)写出各物质的化学式:A________;B________;C________;D________;E________。
(2)写出反应①的化学方程式:______________________________________,该反应中氧化剂与还原剂的物质的量之比为________。
(3)写出反应④的离子方程式:______________________________________。
(4)写出反应⑤的离子方程式:______________________________________。
(5)H2CO3的酸性强于E的,请用离子方程式予以证明:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示每一方框表示一种反应物或生成物,其中A、C、D、E、F在通常情况下均为气体,且加热X生成的A与C的物质的量之比为1∶1,B为常见液体。
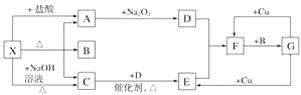
试回答下列问题:
(1)X是________(填化学式,下同),F是__________。
(2)A―→D反应的化学方程式为_______。
(3)G与Cu的反应中,G表现的性质为______。
(4)X与过量NaOH溶液反应生成C的离子方程式为_____________。
(5)以C、B、D为原料可生产G,若使amol C完全转化为G,理论上至少需要D___ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用电解法测量某工业废气中CO的浓度,工作原理如图所示。下列说法正确的是
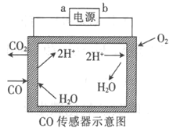
A.b为电源的正极B.阳极的电极反应式为CO+H2O-2e-=CO2+2H+
C.H+向阳极移动D.理论上每消耗11.2 L O2,转移2 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)同温同压下,同体积的N2和SO2分子数之比为__________________,物质的量之比为____________,原子总数之比为____________,摩尔质量之比为__________,质量之比为________________,密度之比为______________。
(2)现有质量比为11:14的CO2和CO的混合气体,则该混合气体中的CO2和CO物质的量之比为________,碳原子和氧原子的个数比为________,该混合气体的摩尔质量为________。
(3)12.4gNa2X中含Na+ 0.4mol,则Na2X的摩尔质量是________,X的相对原子质量是________。
(4)人造空气(氧气和氦气的混合气)可用于减轻某些疾病或供深水潜水员使用。在标准状况下,11.2L“人造空气”的质量是4.8g,其中氧气和氦气的分子数之比是______,氧气的质量是_______。
(5)某元素的一个原子的质量为ag,一个12C原子的质量为bg,阿伏加德罗常数为NA,则该原子的相对原子质量数值可表示为______________或_______________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t℃时,将 a g NH3完全溶于水,得到V mL溶液,假设该溶液的密度为ρ g·cm-3,质量分数为ω ,其中含NH4+的物质的量为 b moL。下列叙述中正确的是
A.溶质的质量分数为ω=![]() 100%
100%
B.溶质的物质的量浓度 c ![]() mol L1
mol L1
C.溶质一水合氨是强电解质
D.上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5ω
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向0.10 mol·L-1的Na2CO3溶液中逐滴加入稀盐酸,加入的HCl与原溶液中Na2CO3的物质的量之比f[f=![]() ]与混合液pH的关系如图所示。下列说法正确的是( )
]与混合液pH的关系如图所示。下列说法正确的是( )

A.f=0时,溶液中:c(Na+)=2c(![]() )
)
B.f=0.5时,溶液中:c(![]() )>c(
)>c(![]() )
)
C.f=1时,溶液中:c(Na+)+c(H+)=2c(![]() )+c(
)+c(![]() )+c(OH-)
)+c(OH-)
D.f=2时,溶液中:![]() c(Na+)=c(
c(Na+)=c(![]() )+c(
)+c(![]() )+c(H2CO3)
)+c(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语对事实的表述正确的是
A.硬脂酸与乙醇的酯化反应:C17H35COOH+C2H518OH![]() C17H35COOC2H5+H218O
C17H35COOC2H5+H218O
B.向Na2SiO3溶液中通入过量的SO2:SiO32-+SO2+H2O=H2SiO3↓+SO32-
C.由Na和C1形成离子键的过程:![]()
D.已知电离平衡常数:H2CO3>HClO>HCO3-,向NaClO溶液中通入少量CO2:2ClO-+CO2+H2O=2HClO+CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,将1.0L c mol·L-1 CH3COOH溶液与0.1mol NaOH固体混合,使之充分反应。然后向该混合溶液中通入HCl气体或加入NaOH固体(忽略体积和温度变化),溶液pH随通入(或加入)物质的物质的量的变化如图所示。下列叙述错误的是( )
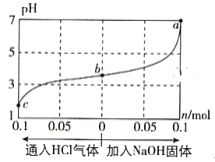
A. 水的电离程度:a>b>c
B. c点对应的混合溶液中:c(CH3COOH)>c(Na+)>c(OH-)
C. a点对应的混合溶液中:c(Na+)=c(CH3COO-)
D. 该温度下,CH3COOH的电离平衡常数![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com