
【题目】用电解法测量某工业废气中CO的浓度,工作原理如图所示。下列说法正确的是
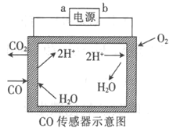
A.b为电源的正极B.阳极的电极反应式为CO+H2O-2e-=CO2+2H+
C.H+向阳极移动D.理论上每消耗11.2 L O2,转移2 mol电子
【答案】B
【解析】
根据示意图,在左侧,CO和水生成了CO2和H+,则CO中C的化合价升高,发生氧化反应,在电解池中阳极发生氧化反应,则a为电源的正极,阳极反应为CO-2e-+H2O=CO2+2H+;b为电源的负极,根据图示,阴极反应为2H++2e-=H2↑。
A、根据图示,右侧,H+得到电子,生成H2,发生还原反应,电解池中阴极发生还原反应,则b为电极的负极,A错误;
B、根据示意图,左侧,CO和水生成了CO2和H+,CO中C的化合价升高,发生氧化反应,阳极反应为CO-2e-+H2O=CO2+2H+;B正确;
C、电解池中,阳离子向阴极移动,H+向阴极移动,C错误;
D、没有说明气体所处的状态,无法得知11.2LO2的物质的量,D错误;
答案选B。


科目:高中化学 来源: 题型:
【题目】下列有关硅及其化合物的说法不正确的是( )
A.晶体硅具有金属光泽,可以导电,属于金属材料
B.常温下,硅化学性质稳定,自然界中的硅主要以氧化物及硅酸盐的形式存在
C.![]() 是一种酸性氧化物,能够与强碱反应生成相应的盐
是一种酸性氧化物,能够与强碱反应生成相应的盐
D.除去![]() 中混有的
中混有的![]() 可加入适量的稀盐酸,然后再过滤
可加入适量的稀盐酸,然后再过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汉黄芩素是传统中草药黄芩的有效成分之一,对肿瘤细胞的杀伤有独特作用。下列有 关汉黄芩素的叙述正确的是
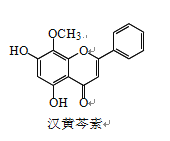
A. 汉黄芩素的分子式为 C16H13O5
B. 该物质遇 FeCl3 溶液显色
C. 1 mol 该物质与溴水反应,最多消耗 1 mol Br2
D. 与足量 H2 发生加成反应后,该分子中官能团的种类减少 1 种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学已渗入我们的“衣、食、住、行、医”中。
(1)衣:区分羊毛线和棉纱线的方法是灼烧,羊毛线燃烧食能闻到__________气味。
(2)食:维生素C能增强人体对疾病的抵抗能力,中学生每天要补充60mg的维C。下列物质富含维生素C的是 ________![]() 填字母
填字母![]() 。
。
A.橙子 ![]() 猪肉
猪肉 ![]() 面粉
面粉
(3)住:下列属于直接利用太阳能辐射能加热物体而获得热能的是 ________![]() 填字母
填字母![]() 。
。
A.石蜡燃烧 ![]() 太阳能热水器
太阳能热水器 ![]() 燃料电池
燃料电池
(4)行:城市交通中大力推广新能源汽车对于改善空气质量的好处是 _______________
A.增加新型污染 ![]() 浪费电能
浪费电能 ![]() 减少空气污染
减少空气污染
(5)医:出现低血糖症状时需要尽快补充葡萄糖,葡萄糖的化学式是________。
(6)淀粉和纤维素是两种重要的多糖,这两种物质________![]() 填“能”或“不能”
填“能”或“不能”![]() 互称为同分异构体,淀粉遇到______显蓝色。
互称为同分异构体,淀粉遇到______显蓝色。
(7)发育出现障碍,患营养缺乏症,这主要是由摄入蛋白质不足引起的,蛋白质在人体内水解的最终产物是________;向蛋白质溶液中加入![]() 溶液会出现白色沉淀,该变化叫作________。
溶液会出现白色沉淀,该变化叫作________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10mL0.1mol/L的某一元酸HR溶液中逐滴加入0.1mol/L氨水,所得溶液pH及导电能力变化如图。下列分析不正确的是( )

A. a~b点导电能力增强说明HR为弱酸
B. a、b点所示溶液中水的电离程度不相同
C. b恰好完全中和,pH=7说明NH4R没有水解
D. c 点溶液存在c(NH4+)>c(R-)、c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pAg=-lgc(Ag+),pX=-lg c(Xn-)。298K时,几种物质的Ksp如下表:
化学式 | AgCl | AgSCN | Ag2CrO4 |
颜色 | 白 | 浅黄 | 红 |
Ksp | 1.8×1010 | 1.0×1012 | 2.0×1012 |
AgCl、AgSCN、Ag2CrO4的饱和溶液中,阳离子和阴离子的浓度关系如图所示。下列说法正确的是
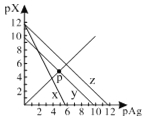
A.图中x代表AgCl曲线,z代表AgSCN曲线
B.298K时,在Cl-和CrO42-的物质的量浓度均为0.1mol/L的溶液中,滴入少量0.1mol/L的AgNO3溶液,首先产生的是红色沉淀
C.298K时若增大p点的阴离子浓度,则y上的点沿曲线向上移动
D.298K时Ag2CrO4(s)+2SCN-(aq) ![]() 2AgSCN(s)+CrO42- (aq)的平衡常数K=2.0×1012
2AgSCN(s)+CrO42- (aq)的平衡常数K=2.0×1012
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是在相同温度下,三种酸的一些数据,下列说法正确的是( )
酸 | HX | HY | HZ | ||
浓度(mol/L) | 0.12 | 0.2 | 0.9 | 1 | 1 |
电离度 | 0.25 | 0.2 | 0.1 | 0.3 | 0.5 |
电离常数 | K1 | K2 | K3 | K4 | K5 |
A.相同温度下,从HX的数据可以说明:弱电解质溶液浓度越低,电离度越大,且K1>K2>K3=0.1
B.室温时,若在NaZ溶液中加水,则 的比值变小,若加少量盐酸,则比值变大
的比值变小,若加少量盐酸,则比值变大
C.等物质的量的NaX、NaY和NaZ的混合,c(X-)+c(Y-)-2c(Z-)=2c(HZ)-c(HX)-c(HY),且c(Z-)<c(Y-)<c(X-)
D.相同温度下,K5>K4>K3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO、NO2是大气污染物,但只要合理利用也是重要的资源。
(1)NH3还原法可将NO2还原为N2进行脱除。
已知:①4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H1=-1530 kJ·mol-1
②N2(g)+O2(g)=2NO(g) △H2=+180 kJ·mol-1
写出NH3还原NO的热化学方程式:_________________________________________。
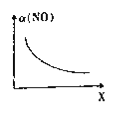
(2)亚硝酰氯(ClNO)是合成有机物的中间体。将一定量的NO与Cl2充入一密闭容器中,发生反应:2NO(g)+Cl2(g)![]() 2ClNO(g) △H<0。平衡后,改变外界条件X,实验测得NO的转化率a(NO)随X的变化如图所示,则条件X可能是________(填字母)。
2ClNO(g) △H<0。平衡后,改变外界条件X,实验测得NO的转化率a(NO)随X的变化如图所示,则条件X可能是________(填字母)。
a.温度 b.压强 c.![]() d.与催化剂的接触面积
d.与催化剂的接触面积
(3)在密闭容器中充入4 mol CO和5 mol NO,发生反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H1=-746.5 kJ·mol-1,图为平衡时NO的体积分数与温度、压强的关系曲线图。
N2(g)+2CO2(g) △H1=-746.5 kJ·mol-1,图为平衡时NO的体积分数与温度、压强的关系曲线图。
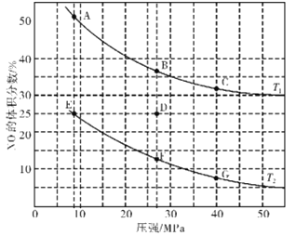
①温度:T1_______(填“<”或“>”)T2。
②若反应在D点达到平衡,此时对反应进行升温且同时扩大容器体积使平衡压强减小,重新达到平衡,则D点应向图中A~G点中的_______点移动。
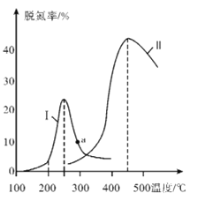
③某研究小组探究催化剂对CO、NO转化的影响。将NO和CO以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中NO含量,从而确定尾气脱氮率(脱氮率即NO的转化率),结果如图所示。温度低于200℃时,图中曲线I脱氮率随温度升高而变化不大的主要原因为____________;a点_______(填“是”或“不是”)对应温度下的平衡脱氮率,说明其理由:___________________________________。
(4)以连二硫酸根(S2O42-)为媒介,使用间接电化学法处理燃煤烟气中的NO,装置如图4所示:

①阴极区的电极反应式为______________________________________。
②NO被吸收转化后的主要产物为NH4+,若通电时电路中转移了0.3 mol e-,则此通电过程中理论上被吸收的NO在标准状况下的体积为____________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向1L0.1mol/LNH4Cl溶液中,不断加入固体NaOH后,NH4+与NH3·H2O的变化趋势如右图所示(不考虑体积变化和氨的挥发)。下列说法不正确的是

A. M点溶液中水的电离程度比原溶液小
B. 在M点时,n(OH-)-n(H+)=(a-0.05)mol
C. 随着NaOH的加入,  不断增大
不断增大
D. 当n(Na0H)=0.1mol时,c(Na+)=c(NH4+)+c(NH3·H2O)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com