
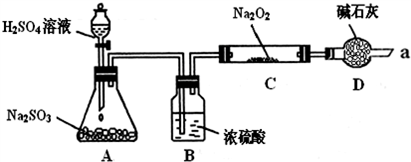

| 实验步骤 | 预期现象和结论 |
| ①取少量C中固体产物于试管中,加入适量的蒸馏水溶解 | |
| ② | |
| ③ |
| 实验步骤 | 预期现象和结论 |
| ①取少量C中固体产物于试管中,加入适量的蒸馏水溶解 | |
| ②滴加过量的1 mol?L-1BaCl2溶液 | 若产生白色沉淀,则证明有Na2SO3或Na2SO4 |
| ③滴加适量的1 mol?L-1的稀盐酸 | 若白色沉淀部分溶解,并产生剌激性气味气体,则证明有Na2SO3和Na2SO4,即假设3成立 |
| 实验步骤 | 预期现象和结论 |
| ①取少量C中固体产物于试管中,加入适量的蒸馏水溶解 | |
| ②滴加过量的1 mol?L-1稀盐酸 | 若产生剌激性气味气体,则证明有Na2SO3 |
| ③滴加适量的1 mol?L-1BaCl2溶液 | 若产生白色沉淀,则证明有Na2SO4.综合上述,假设3成立 |


科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:
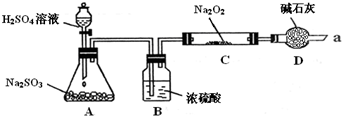
| 实验操作 | 预期现象 | 结 论 |
| 步骤一:取少量C中固体产物于试管中,加入适量的蒸馏水溶解,分别取少量于A、B试管中 | 固体完全溶解,得到无色透明溶液 | / |
| 步骤二:取试管A,向溶液中加入 |
假设1 或假设3成立;若没有该现象则假设2成立. | |
| 步骤三:取试管B,向其中先加入 再加入 |
产生 再加入试剂看到产生白色沉淀. |
假设3成立.若无白色沉淀产生则假设1成立. |
查看答案和解析>>
科目:高中化学 来源:2011-2012学年浙江省高三上学期第二次统练化学试卷 题型:实验题
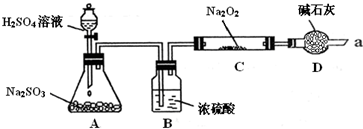
(16分).某同学想通过下图装置(夹持装置已略去)实验,探究SO2与Na2O2反应的产物。
Ⅰ.装置B的作用 。
装置D的作用 。
Ⅱ.如何检验反应中是否有O2生成
。
Ⅲ.对C中固体产物提出如下假设:
假设1:只有Na2SO3
假设2:只有Na2SO4
假设3: 。
(1)假设2的反应方程式为 。
(2)若Na2O2反应完全,为确定C中固体产物的成分,甲设计如下实验:

得出结论:产物是Na2SO4。
该方案是否合理 (填“是”或“否”),理由是 。
(3)设计实验验证假设3:取少量C中固体产物于试管中,加入适量的蒸馏水溶解, ,则假设3成立。(写明操作与对应的现象)
查看答案和解析>>
科目:高中化学 来源:2011-2012学年广东省高三9月月考化学试题 题型:实验题
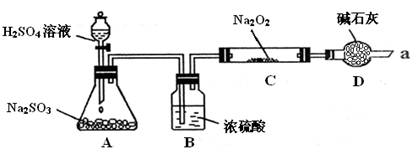
(16分)某同学想通过下图装置实验、探究SO2与Na2O2反应的产物。
(夹持装置已略去,装置的气密性良好)
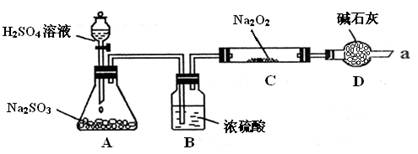
Ⅰ.装置B的作用是吸收水,干燥SO2气体,其原因是(用离子方程式表示)
。
装置D除了吸收过量的SO2,避免污染空气外,还起到的作用是
。
Ⅱ.某同学想通过上图实验装置,检验反应中是否有O2生成时,其实验操作步骤是:
① 先
②再用带火星的木条靠近干燥管口a,观察其是否复燃。
Ⅲ.对C中固体产物提出如下假设:
假设1:只有Na2SO3
假设2:只有Na2SO4
假设3: 。
(1)若假设2成立,写出所发生反应的化学方程式
。
(2)若Na2O2反应完全,为确定C中固体产物的成分,甲设计如下实验:

得出结论:产物是Na2SO4。
该方案是否合理 (填“是”或“否”)。
(3)设计实验验证假设3的实验步骤如下:
|
实验步骤 |
实验现象 |
|
①滴加入过量的稀盐酸 |
产生剌激性气味气体 |
|
②滴加入适量的BaCl2溶液 |
产生白色沉淀。 |
|
③取少量C中固体产物于试管中,加入适量的蒸馏水溶解 |
|
若假设3成立,正确的实验操作顺序是
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com