
【题目】下列关于元素化合物的化学用语不正确的是
A.氟离子的结构示意图:![]()
B.H和Cl形成共价键的过程:![]()
C.铅蓄电池放电时的负极反应:Pb(s)+SO42-(aq)-2e-=PbSO4(s)
D.![]() 氧化
氧化![]() 生成单质硫:
生成单质硫:![]()
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种元素,它们的原子序数依次增大,但均小于18,A和B在同一周期,A的电子式为·![]() ·,B原子L层的电子总数是K层的3倍,0.1 mol C单质能从酸中置换出2.24 L(标准状况)氢气,同时它的电子层结构变成与氖原子相同的电子层结构;D离子的半径比C离子的小,D离子与B离子的电子层结构相同。
·,B原子L层的电子总数是K层的3倍,0.1 mol C单质能从酸中置换出2.24 L(标准状况)氢气,同时它的电子层结构变成与氖原子相同的电子层结构;D离子的半径比C离子的小,D离子与B离子的电子层结构相同。
(1)写出A、B、C、D元素的名称:A________,B______,C________,D________。
(2)D元素在周期表中属于第________周期______族。
(3)用电子式表示A的气态氢化物的形成过程:____________。
(4)A和B的单质充分反应生成的化合物的结构式是___________。
(5)B与C形成的化合物是离子化合物还是共价化合物?如何证明?_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
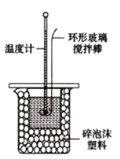
【题目】实验室用50mL 0.50mol/L盐酸、50mL0.55mol/L NaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:
实验次数 | 起始温度/℃ | 终止温度/℃ | |
盐酸 | NaOH溶液 | ||
1 | 20.2 | 20.3 | 23.7 |
2 | 20.3 | 20.5 | 23.8 |
3 | 21.5 | 21.6 | 24.9 |
完成下列问题:
(1)实验时不能用铜丝搅拌棒代替环形玻璃搅拌棒的理由是___。实验中使用环形玻璃搅拌棒的操作方法是____;
(2)在操作正确的前提下,提高中和热测定准确性的关键是_____;
(3)根据表中所测数据进行计算,则该实验测得的中和热![]() =_____ [盐酸和NaOH溶液的密度按1
=_____ [盐酸和NaOH溶液的密度按1![]() 计算,反应后混合溶液的比热容(c)按4.18
计算,反应后混合溶液的比热容(c)按4.18![]() 计算]。如果用0.5mol/L的盐酸与NaOH固体进行实验,则实验中测得的中和热将______ (填“偏大”“偏小”或“不变”)。
计算]。如果用0.5mol/L的盐酸与NaOH固体进行实验,则实验中测得的中和热将______ (填“偏大”“偏小”或“不变”)。
(4)若某同学利用上述装置做实验,有些操作不规范,造成测得中和热数值偏低,请你分析可能的原因是__________;
A.测量盐酸的温度后,温度计没有用水冲洗干净 B.把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓 C.做本实验的当天室温较高 D.在量取盐酸时仰视读数 E.大烧杯的盖板中间小孔太大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】偏二甲肼与N2O4是常用的火箭推进剂,二者发生如下化学反应:
(Ⅰ)(CH3)2NNH2(l)+2N2O4(l)=2CO2(g)+3N2(g)+4H2O(g)
(Ⅱ)N2O4(g)2NO2(g)
(1)反应(Ⅰ)中氧化剂是___。
(2)当温度升高时,气体颜色变深,则反应(Ⅱ)为___(填“吸热”或“放热”)反应。
(3)若在相同温度下,上述反应改在体积为1L的恒容密闭容器中进行,平衡常数___(填“增大”“不变”或“减小”),反应3s后NO2的物质的量为0.6mol,则0~3s内的平均反应速率v(N2O4)=_______molL-1s-1。
(4)NO2可用氨水吸收生成NH4NO3。25℃时,将amolNH4NO3溶于水,溶液显酸性,原因是___(用离子方程式表示)。
(5)向该溶液滴加bL氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将___(填“正向”“不”或“逆向”)移动,所滴加氨水的浓度为___mol·L-1。(NH3·H2O的电离平衡常数取Kb=2×10-5mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼酸(H3BO3)是有重要用途的一元弱酸。请回答下列问题:
(1)单质硼溶于热的浓硝酸可以生成硼酸,该反应的化学方程式为___________。
(2)利用铁硼矿(主要成分为Mg2B2O5·H2O和Fe3O4,还有少量Fe2O3、FeO、CaO、Al2O3和SiO2等)制硼酸,已知天然的Fe3O4不溶于酸。生产硼酸的工艺流程如下:
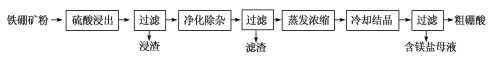
①“浸渣”主要成分的化学式为_____________。
②“净化除杂”:滤液保持一定温度,需先加H2O2溶液,然后再调节溶液的pH=5.6。温度不宜过高的原因是___________。调节溶液的pH=5.6的主要目的是___________。
[已知:Ksp[Fe(OH)3]=2.6×10-39], Ksp[Al(OH)3]=1.3×10-33,
[已知:Ksp[Fe(OH)2]=4.7×10-6], Ksp[Mg(OH)2]=5.6×10-12,
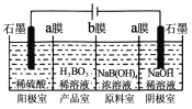
(3)硼酸也可以通过电解方法制备。工作原理如图所示。
①写出阳极的电极反应式___________________。
②a膜或b膜为阳离子交换膜的是________;阴极室溶液的浓度________(填“变大”、“不变”、“变小”)。
(4)写出一定条件下硼酸与氢氧化钠溶液反应的化学方程式_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置能达到实验目的是(夹持仪器未画出)( )
选项 | A | B | C | D |
实验装置 |
|
|
|
|
实验目的 | 用于检验溴丙烷消去产物 | 用于石油的分馏 | 用于实验室制硝基苯 | 用于实验室制备乙烯 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)据报道,我国在南海进行的可燃冰(甲烷的水合物)试采获得成功。甲烷是一种重要的化工原料。甲烷重整是提高甲烷利用率的重要方式,除部分氧化外还有以下两种:
水蒸气重整:CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH1=+205.9kJ·mol-1 ①
CO(g)+3H2(g) ΔH1=+205.9kJ·mol-1 ①
CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH2=-41.2kJ·mol-1 ②
CO2(g)+H2(g) ΔH2=-41.2kJ·mol-1 ②
二氧化碳重整:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) ΔH3 ③
2CO(g)+2H2(g) ΔH3 ③
则反应①自发进行的条件是___(填“低温”或“高温”),ΔH3=__kJ·mol-1。
(2)根据部分键能数据,以及热化学方程式CH4(g)+4F2(g)=CF4(g)+4HF(g) ΔH=-1940kJ·mol-1,计算H—F键的键能为__kJ·mol-1。
化学键 | C—H | C—F | H—F | F—F |
键能/(kJ·mol-1) | 414 | 489 | ? | 155 |
(3)0.1mol的氯气和焦炭、TiO2固体完全反应,生成TiCl4液体和CO气体,放出热量4.28kJ,写出该反应的热化学方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中某些气体的制取、收集、尾气处理![]() 或性质实验
或性质实验![]() 装置如图所示,用此装置和下表中提供的物质完成相关实验,合理的选项是
装置如图所示,用此装置和下表中提供的物质完成相关实验,合理的选项是![]()
选项 | Ⅰ中的物质 | Ⅱ中收集的气体 | Ⅲ中的物质 |
|
A | Cu和稀硝酸 | NO | NaOH溶液 | |
B | 浓盐酸和 |
| NaOH溶液 | |
C | 亚硫酸钠和浓硫酸 |
| 品红溶液 | |
D | 浓氨水和CaO |
| 酚酞溶液 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com