
将不可再生的天然气、石油、煤等化石燃料转化利用、变废为宝已成为当务之急。
(1)根据键能数据估算CH4+4F2=CF4+4HF的反应热ΔH= 。
化学键 | C—H | C—F | H—F | F—F |
键能/(kJ·mol-1) | 414 | 489 | 565 | 155 |
(2)甲醇、二甲醚(CH3OCH3)被称为21世纪的新型燃料,均可利用CO和H2反应合成。
①某燃料电池以二甲醚为原料,熔融碳酸盐为电解质,其负极反应如下:
CH3OCH3+6CO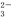 -12e-=8CO2+3H2O。写出该燃料电池的正极反应式: 。
-12e-=8CO2+3H2O。写出该燃料电池的正极反应式: 。
②废水中含甲醇对水质会造成污染,Co3+可将甲醇氧化为CO2。某同学以Pt作电极电解酸性含甲醇废水与CoSO4混合液模拟工业除污原理,其阳极反应式为 。
(3)某企业采用如图所示原理处理化石燃料开采、加工过程产生的H2S废气。
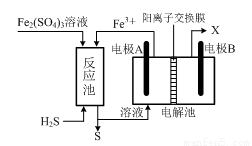
①电解池中电极A、B均为惰性电极,其中A为电解池的 极;电极B所得到的物质X的分子式为 。
②反应池中发生的离子反应方程式为 。
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 工业上冶炼活泼金属的单质都是通过电解法 | |
| B. | 工业上冶炼粗硅是用热还原法 | |
| C. | 消耗等质量的氢气,碱性氢氧电池放电量大于酸性介质的放电量 | |
| D. | 硫酸工业的尾气可以用氨水吸收并制得铵盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=4的醋酸中:c(H+)=4.0mol/L | |
| B. | pH=12的烧碱溶液中:c(OH-)=1.0×10-2mol/L | |
| C. | 饱和食盐水中:c(H+)=c(OH-) | |
| D. | 饱和小苏打溶液中:c(Na+)=c(HCO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
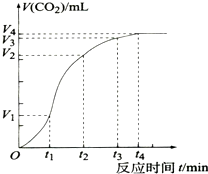 为了研究CaCO3与稀盐酸反应的反应速率,某同学通过实验测定反应中生成的CO2气体体积随反应时间变化的情况,绘制曲线(图),已知该反应是放热反应,请分析讨论以下问题:
为了研究CaCO3与稀盐酸反应的反应速率,某同学通过实验测定反应中生成的CO2气体体积随反应时间变化的情况,绘制曲线(图),已知该反应是放热反应,请分析讨论以下问题:查看答案和解析>>
科目:高中化学 来源:2017届江苏省如皋市高三上学期质量调研一化学试卷(解析版) 题型:填空题
氧化还原反应在生产生活中有着重要的应用。请按要求写出相应的方程式。
(1)将含SO2的废气通入含Fe2+(催化剂)的溶液中,常温下可使SO2转化为SO2-4,其总反应为2SO2+O2+2H2O=2H2SO4。上述总反应分两步进行,第一步反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O,写出第二步反应的离子方程式: 。
(2)pH=3.6时,碳酸钙与硫酸铝反应可制备碱式硫酸铝[Al2(SO4)x(OH)6-2x]溶液。若溶液的pH偏高,则碱式硫酸铝产率降低且有气泡产生,用化学方程式表示其原因: 。
(3)ClO2是一种高效安全的杀菌消毒剂。氯化钠电解法生产ClO2工艺原理示意图如下:

①写出氯化钠电解槽内发生反应的离子方程式: 。
②写出ClO2发生器中的化学方程式,并标出电子转移的方向及数目: 。
③ClO2能将电镀废水中的CN-离子氧化成两种无毒气体,自身被还原成Cl-。写出该反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源:2017届江苏省如皋市高三上学期质量调研一化学试卷(解析版) 题型:选择题
下列物质的转化在给定条件下能实现的是
A.Fe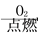 Fe2O3
Fe2O3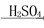 Fe2(SO4)3
Fe2(SO4)3
B.MgO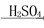 MgSO4(aq)
MgSO4(aq)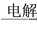 Mg
Mg
C.饱和NaCl(aq)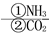 NaHCO3
NaHCO3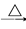 Na2CO3
Na2CO3
D.NH3 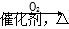 NO
NO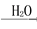 HNO3
HNO3
查看答案和解析>>
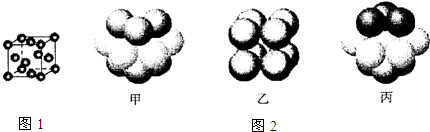
科目:高中化学 来源: 题型:推断题
| 元素 | 结构或性质信息 |
| T | 原子的L层上s电子数等于p电子数. |
| X | 元素的原子半径是第三周期主族元素中最大的. |
| Y | 空气中含其单质,原子的最外层未成对电子数是该元素所在周期中最多的. |
| Z | 单质常温常压下是气体.原子的M层上有1个未成对的p电子. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯能使酸性高锰酸钾溶液褪色 | |
| B. | 乙烯可以燃烧 | |
| C. | 苯能使酸性高锰酸钾溶液褪色 | |
| D. | 苯通常易发生取代反应较难发生加成反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com