
药物贝诺酯可由乙酰水杨酸和对乙酰氨基酚在一定条件下反应制得:

下列有关叙述正确的是
A.贝诺酯分子中有两种含氧官能团
B.可用FeCl3 溶液区别乙酰水杨酸和对乙酰氨基酚
C.乙酰水杨酸和对乙酰氨基酚均能与NaHCO3 溶液反应
D.贝诺酯与足量NaOH 溶液共热,最终生成乙酰水杨酸钠和对乙酰氨基酚钠
科目:高中化学 来源: 题型:
X、Y、Z、W、P为短周期的主族元素,其原子序数依次增大。Y、Z、W、P位于同一周期。X元素形成的单质是自然界中含量最多的气体,1mol Y的单质分别与足量盐酸和氢氧化钠溶液反应生成的气体在标况下均为33.6L。W的原子最外层电子数与核外电子总数之比为3∶8,X的原子序数是Z的原子序数的一半。
(1)Z的原子结构示意图为 ,W与P可形成原子个数比为1∶2的化合物,其电子式为 。
(2)经测定,在2.5×1.01×105 Pa下,Y 与P形成的化合物的熔点为190℃,沸点为180℃,则该化合物为 晶体。
(3)Z、W、P三种元素的气态氢化物稳定性由高到低的顺序是 (填化学式)。
(4)Y与W形成的化合物遇水分解,发生反应的化学方程式为 。
(5)X的三氟化物是微电子工业中优良的等离子刻蚀气体,但在潮湿的环境中能与水发生反应生成无色气体,遇空气变为红棕色。该反应的化学方程式为 ,若0.6mol X的三氟化物完全反应,则转移的电子总数约为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
关于下列各装置图的叙述中,正确的是

A.若采用装置①精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液
B.装置②是原电池,能将化学能转化为电能,锌电极发生还原反应
C.装置③中X若为四氯化碳,可用于吸收氨气或氯化氢,并防止倒吸
D.装置④可用于收集氨气,并吸收多余的氨气
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学活动小组设计如下图所示(部分夹持装置已略去)实验装置,以探究潮湿的Cl2与Na2CO3反应得到的固体物质。

(1)写出装置A中发生反应的离子方程式:
(2)写出试剂Y的名称:_____________________。
(3)已知:通入一定量的氯气后,测得D中只有一种常温下为黄红色的气体,其为含氯氧化物。可以确定的是C中含有的氯盐只有一种,且含有NaHCO3,现对C成分进行猜想和探究。
①提出合理假设:
假设一:存在两种成分: NaHCO3和__________
假设二:存在三种成分: NaHCO3和__________、___________。
②设计方案,进行实验。请写出实验步骤以及预期现象和结论(可不填满)。
限选实验试剂和仪器:蒸馏水、稀硝酸、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯。
| 实验步骤 |
|
| 步骤1:取C中的少量固体样品于试管中,滴加 足量蒸馏水至固体溶解,然后将所得溶液分别置于A、B试管中。 | |
| 步骤2:向A试管中滴加______________: | ①若无明显现象,证明固体中不含碳酸钠; ②若溶液变浑浊,证明固体中含有碳酸钠。 |
| 步骤3:向B试管中滴加______________: | 若溶液变浑浊,结合步骤2中的①,则假设 一成立:结合步骤2中的②,则假设二成立。 |
(4)己知C中有0.1 mol Cl2参加反应。若假设一成立,可推知C中反应的化学方程式为
。
(5)常温下Na2CO3和NaHCO3均为0.1mol/L的混合溶液中,c(OH﹣)-c(H+)=___________(用含碳元素的粒子浓度表示),在该溶液中滴加稀盐酸至中性时,溶液中溶质的成分有______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:(NH4)2CO3(s)=NH4HCO3(s)+NH3(g) △H=74.9 kJ·mol-1,下列说法中正确的是
A.该反应中熵变、焓变皆大于0
B.该反应是吸热反应,因此一定不能自发进行
C.碳酸盐分解反应中熵增加,因此任何条件下所有碳酸盐分解一定自发进行
D.能自发进行的反应一定是放热反应,不能自发进行的反应一定是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
已知酸性 >H2CO3>
>H2CO3> >HCO3―,向Na2CO3溶液中逐滴加入水杨酸(
>HCO3―,向Na2CO3溶液中逐滴加入水杨酸( )溶液,可能发生的反应的离子方程式书写正确的是
)溶液,可能发生的反应的离子方程式书写正确的是
A. +CO32―→
+CO32―→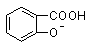 +HCO3―
+HCO3―
B. +CO32―→
+CO32―→ +HCO3―
+HCO3―
C.2 +CO32―→2
+CO32―→2 +CO2↑
+CO2↑
D.3 +2CO32―→3
+2CO32―→3 +HCO3―+H2O+CO2↑
+HCO3―+H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
若NA表示阿伏加德罗常数,下列说法正确的是
A.含有NA个氖原子的氖气在标准状况下的体积约为11.2L
B.2.3gNa被O2完全氧化时,失去电子数为0.1NA
C.2Llmol/L的盐酸中所含氯化氢分子数约为2NA
D.标准状况下,5.6LCCl4含有的分子数为0.25NA
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y为短周期元素,X位于第IA族,X与Y可形成化合物X2Y,下列说法不正确的是
A.两元素还可能形成原子个数比为1:1的化合物
B.X与Y的简单离子可能具有相同电子层结构
C. X的原子半径一定大于Y的原子半径
D.X2Y可能是离子化合物,也可能是共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
氯化硼的熔点为-107℃,沸点为12.5℃,在其分子中键与键之间的夹角为120o,它能水解,
有关叙述正确的是:
A.氯化硼液态时能导电而固态时不导电
B.氯化硼加到水中使溶液的pH升高
C.氯化硼遇水蒸气会产生白烟
| |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com