
【题目】下列说法不正确的是( )
A. 在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH
B. 乙醛和丙烯醛不是同系物,它们与H2充分反应后的产物是同系物
C. 用溴水可以鉴别苯酚溶液、2,4-己二烯、甲苯和CCl4
D. 乳酸薄荷醇酯(![]() )能发生水解反应、氧化反应、消去反应、取代反应
)能发生水解反应、氧化反应、消去反应、取代反应
科目:高中化学 来源: 题型:
【题目】标号为①~⑩的元素,在元素周期表中的位置如下:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
1 | ① | ② | ||||||
2 | ③ | ④ | ⑤ | ⑥ | ||||
3 | ⑦ | ⑧ | ⑨ | ⑩ |
试回答下列问题:
(1)(填写元素符号)① _____③______⑤_____ ⑦_____
(2)①和④号元素形成的化合物的化学式________,用电子式表示其形成过程为__________。
(3)⑦和⑧号元素的最高价氧化物的水化物的碱性是: ______﹥_________ (填化学式)。⑨和⑩号元素的最高价氧化物的水化物的酸性是: ______ ﹥_________ (填化学式)。
(4)①、⑤、⑦号元素形成的一种化合物的电子式是________,在该化合物中既含有________键,又含有________键。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香族化台物肉桂酸甲酯常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精,其球棍模型如图所示(图中球与球之间的棍代表化学键,如单键、双键等)。其制备过程涉及肉桂醇电解制备肉桂醛,肉桂醛氧化制备肉非酸,再与甲醇酯化制得。下列说法不正确的是

A. 肉桂酸甲酯的分子式为C10H10O2
B. 电解肉桂醇制得的肉桂醛在电解池的阴极生成
C. 1mol肉桂酸甲酯与H2加成最多消耗4mol
D. 肉桂酸甲酯中所有碳原子可能在同一平面内
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】咖啡酸具有止血功效,存在于多种中药中,其结构简式为:
(1)写出咖啡酸中两种含氧官能团的名称:______________、____________。
(2)根据咖啡酸的结构,列举咖啡酸可以发生的三种反应类型:________、________、________。
(3)蜂胶的分子式为C17H16O4,在一定条件下可水解生成咖啡酸和一种醇A,则醇A的分子式为________。
(4)已知醇A含有苯环,且分子结构中无甲基,写出醇A在一定条件下与乙酸反应的化学方程式:___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇分子中不同的化学键如图,关于乙醇在各种反应中断裂键的说法不正确的是( )

A. 乙醇和钠反应,键①断裂
B. 在Ag催化下和O2反应,键①③断裂
C. 乙醇和浓H2SO4共热140℃时,键①或键②断裂;在170℃时,键②⑤断裂
D. 乙醇完全燃烧时断裂键①②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某卤块的主要成分是MgCl2,此外还含Fe3+、Fe2+和Mn2+等离子和少量的尿素[CO(NH2)2].利用该卤块为原料生产轻质氧化镁的工艺流程如图:

当相关金属离子[c0(Mn+)=0.1molL﹣1]时,形成氢氧化物沉淀的pH范围如表:
金属离子 | Fe2+ | Fe3+ | Mn2+ | Mg2+ |
开始沉淀的pH | 7.6 | 2.7 | 8.3 | 9.6 |
沉淀完全的pH | 8.3 | 3.7 | 9.8 | 11.1 |
回答下列问题:
(1)NaClO中氯元素的化合价为_____。NaClO为漂白液的主要成分,写出制备漂白液的离子方程式_____。
(2)若溶液b中杂质离子的浓度均为0.1molL﹣1,若要使杂质离子沉淀完全,步骤③应溶液的pH调节至_____,沉淀物A含有Mn(OH)2和_____。
(3)若在实验室中完成步骤⑥,则沉淀物C应在_____(填仪器名称)中灼烧。写出步骤⑥的化学方程式_____。
(4)步骤②加入NaClO还能除去卤块中的尿素[CO(NH2)2],生成一种盐和两种无毒气体及水,其化学方程式为_____,若除去卤快中含有的0.02molCO(NH2)2,需消耗NaClO的质量为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,体积一定的密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度(mol·L-1) | 0.1 | 0.2 | 0 |
平衡浓度(mol·L-1) | 0.05 | 0.05 | 0.1 |
下列说法错误的是
A.反应可表示为X+3Y![]() 2Z,其平衡常数为1600
2Z,其平衡常数为1600
B.增大压强使平衡向生成Z的方向移动,平衡常数增大
C.反应达到平衡时,X的转化率为50%
D.反应起始时和达平衡时的压强比为3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由U形管、质量为m g的铁棒、质量为m g的碳棒和1 L 0.2 mol·L-1 CuCl2溶液组成的装置如图所示,下列说法正确的是
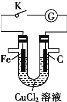
A.打开K,铁棒上有紫红色物质析出
B.闭合K,碳棒上有紫红色固体析出
C.闭合K,当电路中有0.3NA个电子通过时,理论上碳棒与铁棒的质量差为9.6 g
D.闭合K,铁棒表面发生的电极反应为Cu2++2e-=Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为提升电池循环效率和稳定性,科学家近期利用三维多孔海绵状Zn(3DZn)可以高效沉积ZnO的特点,设计了采用强碱性电解质的3DZn—NiOOH二次电池,结构如下图所示。电池反应为Zn(s)+2NiOOH(s)+H2O(l)![]() ZnO(s)+2Ni(OH)2(s)。
ZnO(s)+2Ni(OH)2(s)。

A. 三维多孔海绵状Zn具有较高的表面积,所沉积的ZnO分散度高
B. 充电时阳极反应为Ni(OH)2(s)+OH(aq)e![]() NiOOH(s)+H2O(l)
NiOOH(s)+H2O(l)
C. 放电时负极反应为Zn(s)+2OH(aq)2e![]() ZnO(s)+H2O(l)
ZnO(s)+H2O(l)
D. 放电过程中OH通过隔膜从负极区移向正极区
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com