
【题目】锰及其化合物用途广泛,是生产不锈钢、合金钢、铝锰合金、铜锰合金等的合金元素,高锰酸钾在医疗上用作消毒剂,锰也是人体内多种酶的组成元素。
(1)用酸性KMnO4溶液与亚铁盐的反应证明Fe2+具有还原性、MnO![]() 具有氧化性,最合适的亚铁盐是________[从“FeSO4”、“FeCl2”和“Fe(NO3)2”中选择填入]。
具有氧化性,最合适的亚铁盐是________[从“FeSO4”、“FeCl2”和“Fe(NO3)2”中选择填入]。
(2)工业上由二氧化锰通过铝热反应制备锰,写出反应的化学方程式:________________________。
(3)等物质的量的Al、Mn分别与足量的稀硫酸反应,产生H2的体积比(同温同压)为3∶2,写出Mn与稀硫酸反应的化学方程式:________________________。
(4)在熔融的Mn和KOH混合物中通入O2可制备K2MnO4。若用MnO2代替Mn也可制得K2MnO4,两种情况下制备相同量的K2MnO4消耗O2的物质的量之比为________。
【答案】FeSO4 4Al+3MnO2![]() 3Mn+2Al2O3 Mn+H2SO4=MnSO4+H2↑ 3∶1
3Mn+2Al2O3 Mn+H2SO4=MnSO4+H2↑ 3∶1
【解析】
(1)MnO![]() 具有强氧化性,不仅能氧化Fe2+,还能氧化Cl-;另外,在酸性溶液中,NO3-也能将Fe2+氧化。
具有强氧化性,不仅能氧化Fe2+,还能氧化Cl-;另外,在酸性溶液中,NO3-也能将Fe2+氧化。
(2)工业上,二氧化锰和铝反应,生成锰和氧化铝。
(3)等物质的量的Al、Mn分别与足量的稀硫酸反应,产生H2的体积比(同温同压)为3∶2,因为铝与酸反应,表现+3价,由电子守恒分析,在反应中锰应表现+2价,由此可写出锰与稀硫酸反应的方程式。
(4) 在熔融的Mn和KOH混合物中通入O2可制备K2MnO4,若用MnO2代替Mn也可制得K2MnO4,利用电子守恒,可建立如下关系式:2Mn——3O2——2K2MnO4,2MnO2——O2——2K2MnO4,假设两种情况下制备2molK2MnO4,则消耗O2的物质的量之比。
(1)MnO![]() 具有强氧化性,不仅能氧化Fe2+,还能氧化Cl-;另外,在酸性溶液中,NO3-也能将Fe2+氧化。所以,最合适的亚铁盐是FeSO4。答案为:FeSO4;
具有强氧化性,不仅能氧化Fe2+,还能氧化Cl-;另外,在酸性溶液中,NO3-也能将Fe2+氧化。所以,最合适的亚铁盐是FeSO4。答案为:FeSO4;
(2)工业上,二氧化锰和铝反应,生成锰和氧化铝,由二氧化锰通过铝热反应制备锰,反应的化学方程式为4Al+3MnO2![]() 3Mn+2Al2O3。答案为:4Al+3MnO2
3Mn+2Al2O3。答案为:4Al+3MnO2![]() 3Mn+2Al2O3;
3Mn+2Al2O3;
(3)等物质的量的Al、Mn分别与足量的稀硫酸反应,产生H2的体积比(同温同压)为3∶2,因为铝与酸反应,表现+3价,由电子守恒分析,在反应中锰应表现+2价,由此可写出锰与稀硫酸反应的方程式为Mn+H2SO4=MnSO4+H2↑。答案为:Mn+H2SO4=MnSO4+H2↑;
(4)在熔融的Mn和KOH混合物中通入O2可制备K2MnO4,若用MnO2代替Mn也可制得K2MnO4,利用电子守恒,可建立如下关系式:2Mn——3O2——2K2MnO4,2MnO2——O2——2K2MnO4,假设两种情况下制备2molK2MnO4,则消耗O2的物质的量之比3∶1。
答案为:3∶1。


科目:高中化学 来源: 题型:
【题目】某电镀铜厂有两种废水,分别含有CN-和Cr2O72-等有毒离子,拟用NaClO和Na2S2O3按照下列流程进行处理。
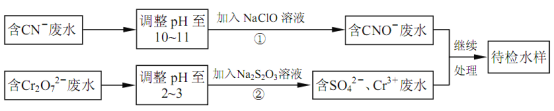
完成下列填空:
(1)HCN有剧毒,电子式是___,其分子属于___(填“极性”、“非极性”)分子。
(2)选用最详尽描述核外电子运动状态的方式,来表示氮原子的最外层电子:___,氮原子核外有___种能量不同的电子。
(3)下列事实能说明氯与硫两元素非金属性相对强弱的是___。
a.相同条件下水溶液的酸性:HClO3>H2SO3
b.稳定性:HCl>H2S
c.相同条件下水溶液的pH:Na2S>NaCl
d.还原性:S2->Cl-
(4)写出流程②的离子方程式:___。
(5)反应②中,每消耗1.5mol Cr2O72-转移电子的数目为___个。
(6)取少量待检水样于试管中,加入NaOH溶液观察到有蓝色沉淀生成,继续加至不再产生蓝色沉淀为止,再向溶液中加入足量Na2S溶液,蓝色沉淀转化成黑色沉淀,用平衡移动原理解释产生该现象的原因___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】经检测,某工业废水显酸性,且废水中含有大量Na+、Cu2+、Cl-、SO42-、NO3-,
(1)下列离子中,不可能大量存在于该废水中的是___(填序号)。
A.K+ B.Fe3+ C.Ag+ D.HCO3-
(2)若向上述废水中加入大量的过氧化钠固体,观察到的现象为___;相关的离子方程式为___。
(3)若工业废水中只含有H+和Na+、Cu2+、Cl-、SO42-、NO3-,经分析测得,H+、Cu2+、Cl-、SO42-、NO3-的物质的量浓度分别为:0.1mol·L-1、0.05mol·L-1、0.2mol·L-1、0.1mol·L-1、0.1mol·L-1,则Na+的物质的量浓度为___。
(4)设计实验方案除去原废水中的Cu2+和SO42-(用流程图表示)(提示:加入的试剂要过量)___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿司匹林(![]() )是有机合成过程中的中间体。
)是有机合成过程中的中间体。
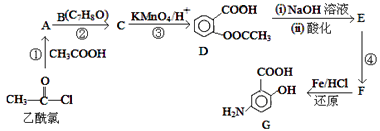
已知:Ⅰ.![]()
Ⅱ.![]() (具有较强的还原性)
(具有较强的还原性)
(1)反应④的试剂和条件为______;反应①的反应类型为______;反应②的作用是_____;
(2)B的结构简式为_______;
(3)下列关于G的描述正确的是______;
A.具有两性,既能与酸反应也能与碱反应
B.能发生加成、消去、取代和氧化反应
C.能聚合成高分子化合物
D.1molG与足量NaHCO3溶液反应放出2molCO2
(4)D与足量的NaOH溶液反应的化学方程式为_______;反应②的化学方程式为_________;
(5)符合下列条件的C的同分异构体
a.属于芳香族化合物,且含有两个甲基
b.既能发生银镜反应又能发生水解反应
其中核磁共振氢谱有4组峰,且峰面积之比为6∶2∶1∶1的是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将Mg、Cu组成的混合物26.4g投入到适量的稀硝酸中,固体完全溶解,收集到标准状况下的NO气体8.96L,向反应后的溶液中加入过量的5mol·L-1的NaOH溶液300mL,金属离子完全沉淀。则形成沉淀的质量是 ( )
A. 43.2gB. 46.8gC. 53.6gD. 63.8g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种易溶于水的黄绿色气体,可用作安全高效的水处理剂,某溶液X中所含ClO2浓度(g·L-1)的实验测定步骤如下:步骤1. 配制Na2S2O3溶液:准确称取1.984 0 g Na2S2O3·5H2O,用新煮沸并冷却的蒸馏水配成100.00 mL溶液。步骤2. 准确移取1.00 mL溶液X加入锥形瓶中,加入丙二酸静置后,再加入适量硫酸及稍过量的KI溶液(2ClO2+10I-+8H+===5I2+2Cl-+4H2O),在暗处放置5 min。步骤3. 向步骤2的锥形瓶的反应液中加入1 mL淀粉溶液作指示剂,再向其中滴加步骤1配制的Na2S2O3溶液(发生反应I2+2Na2S2O3===2NaI+Na2S4O6),至恰好完全反应时消耗Na2S2O3溶液25.00 mL。
(1)步骤1中所配Na2S2O3溶液的物质的量浓度为____mol·L-1,所用玻璃仪器除烧杯、胶头滴管外还有____。(2)配制Na2S2O3溶液时,蒸馏水需煮沸的原因是____。
(3)计算溶液X中所含ClO2浓度(g·L-1)(写出计算过程)____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质A~D均含同种元素,都是中学化学中常见的物质,它们之间可发生如图所示的反应(除A~D外的其他物质均已略去)。
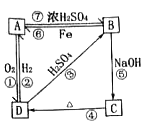
(1)写出相应物质的类别。
物质 | B | C | D |
类别 | ___ | __ | __ |
(2)上述反应①到⑥中,属于离子反应的有___个。
(3)①D→A转化的化学方程式:__。
②B→C转化的离子方程式:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答下列问题:
Ⅰ.工业生产纯碱的工艺流程示意图如图:
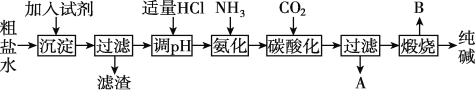
(1)为除去粗盐水中的Mg2+、Ca2+、SO42-等杂质离子,加入试剂顺序合理的是____。
A.碳酸钠、氢氧化钠、氯化钡
B.碳酸钠、氯化钡、氢氧化钠
C.氢氧化钠、碳酸钠、氯化钡
D.氯化钡、氢氧化钠、碳酸钠
(2)工业生产纯碱工艺流程中,碳酸化时产生的现象是____;碳酸化时没有析出碳酸钠晶体,其原因是____。
(3)碳酸化后过滤,滤液A最主要的成分是____(填写化学式),检验这一成分的阴离子的具体方法是____。
(4)煅烧制取Na2CO3在____(填字母序号)中进行。
a.瓷坩埚 b.蒸发皿 c.铁坩埚 d.氧化铝坩埚
Ⅱ.纯碱在生产生活中有广泛的用途。
(5)工业上,可用纯碱代替烧碱生产某些化工产品。如用饱和纯碱溶液与氯气反应可制得有效成分为次氯酸钠的消毒液,其反应的离子方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙(粒子直径在1~100nm之间)。如图所示A~E为实验室常见的仪器装置(部分固定夹持装置略去),请根据要求回答问题。
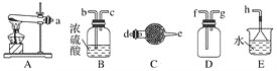
(1)实验室制取、收集干燥的NH3,需选用上述仪器装置的接口连接顺序是(选填字母):a接__、___接__,__接h;实验室用A装置制取NH3的化学方程式为___。
(2)向浓CaCl2溶液中通入NH3和CO2气体制纳米级碳酸钙时,应先通入的气体是___,试写出制纳米级碳酸钙的化学方程式:___。
(3)试设计简单的实验方案,判断所得碳酸钙样品颗粒是否为纳米级:___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com