
【题目】I.50 mL 1.0mol·L-1盐酸跟50 mL 1.1 mol·L-1氢氧化钠溶液在图所示装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热。试回答下列问题:
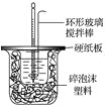
(1)__(填“能”或“不能”)将环形玻璃搅拌棒改为环形金属(如铜)棒。
(2)大烧杯上如不盖硬纸板,对求得中和热数值的影响是__(填“偏高”“偏低”或“无影响”)。
(3)如果改用60 mL 1.0 mol·L-1盐酸跟50 mL 1.1 mol·L-1氢氧化钠溶液进行反应,则与上述实验相比,所放热量__(填“增加”“减少”或“不变”);所求中和热数值__(填“增加”“减少”或“不变”)。
(4)__(填“能”或“不能”)用Ba(OH)2和硫酸代替盐酸和氢氧化钠溶液。
(5)Q=cmΔt,其中Q表示此中和反应放出的热量,m表示反应后混合液的质量,c表示反应后混合溶液的比热容,Δt表示反应前后溶液的温度的差值。该实验小组做了三次实验,每次取溶液各50 mL,并记录如下原始数据:
实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | 温差(t2-t1)/℃ |
1 | 25.0 | 32.6 | |
2 | 25.1 | 31.8 | |
3 | 25.1 | 31.9 |
已知盐酸、NaOH溶液密度近似为1.00 g·cm-3,中和后混合液的比热容c=4.18410﹣3kJ·g-1·℃-1则该反应的中和热为ΔH=__(保留小数点后一位)。
(6)上述实验数值结果与57.3 kJ·mol-1有偏差,产生偏差的原因可能是__(填字母)。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定HCl溶液的温度
II. 草酸与高锰酸钾在酸性条件下能够发生反应:
现用 0.1 mol/L KMnO4酸性溶液与0.5 mol/L H2C2O4溶液,研究不同条件对化学反应速率的影响。实验过程的数据记录如下(见表格),请结合表中信息,回答有关问题:
实验 序号 | 反应温度/℃ | 参加反应的物质 | |||||
KMnO4(H2SO4) | H2C2O4 | H2O | MnSO4 | ||||
V/mL | c/mol·L-1 | V/mL | c/mol·L-1 | V/mL | G | ||
A | 20 | 10 | 0.1 | 10 | 0.5 | 0 | 0 |
B | 20 | 10 | 0.1 | 6 | 0.5 | V1 | 0 |
C | 20 | 10 | 0.1 | 10 | 0.5 | 0 | 1 |
D | 50 | 10 | 0.1 | 6 | 0.5 | 0 | 0 |
E | 40 | 10 | 0.1 | 10 | 0.5 | 0 | 0 |
(1)写出反应的化学方程式_____________________;
(2)如果研究催化剂对化学反应速率的影响,使用实验________和________(用A~E表示,下同);
(3)如果研究温度对化学反应速率的影响,使用实验________和________;
(4)实验A和B,可以研究浓度对化学反应速率的影响,则V1 =_____;
(5)A、B、C三组实验比较,溶液褪色所用的时间最长的是__________组实验。
【答案】不能 偏低 增加 不变 不能 -56.5kJ∕mol acd 2KMnO4+5H2C2O4+3H2SO4==K2SO4+2MnSO4+10CO2↑+8H2O A C A E 4 B
【解析】
I.(1)中和热测定实验成败的关键是防止热量损失;
(2)不盖硬纸板,会有一部分热量散失;
(3)反应放出的热量和所用酸以及碱的量的多少有关,中和热是稀强酸与稀强碱生成1mol水放出的热量;
(4)氢氧化钡与硫酸反应生成了硫酸钡沉淀,生成沉淀的过程中会有热量变化;
(5)先判断三次反应温度差的有效性,然后求出平均值,根据公式Q=cm△T来求出生成0.05mol的水放出热量,最后根据中和热的概念求出中和热;
(6)56.5<57.3,说明实验过程中热量有损失;
II. (1)KMnO4酸性溶液与H2C2O4溶液在酸性条件下发生氧化还原反应生成硫酸钾、硫酸锰、二氧化碳;
(2)根据控制变量法分析(2)(3)(4);
(5)根据影响反应速率的因素分析;
I.(1)中和热测定实验成败的关键是防止热量损失,金属铜的导热效果好于环形玻璃搅拌棒,所以不能将环形玻璃搅拌棒改为环形金属(如铜)棒;
(2)大烧杯上如不盖硬纸板,会有一部分热量散失,求得的中和热数值将会偏低;
(3)50mL 1.0molL-1盐酸跟50mL 1.1molL-1氢氧化钠溶液进行反应,生成水的量为0.050mol,改用60mL 1.0molL-1盐酸跟50mL 1.1molL-1氢氧化钠溶液进行反应,生成0.055molH2O,生成水的量增多,所放出的热量增加,但是中和热是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关,所求中和热数值不变;
(4)硫酸与Ba(OH)2溶液反应除了生成水外,还生成了BaSO4沉淀,生成硫酸钡的过程放热,所以不能用Ba(OH)2溶液和硫酸代替NaOH溶液和盐酸测中和热;
(5)3次反应前后温度差分别为:7.6℃、6.7℃、6.8℃,第一组舍去,平均值为6.75℃,50mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液的质量和m=100mL×1g/mL=100g,c=4.18J/(g℃),代入公式Q=cm△T得生成0.05mol的水放出热量Q=4.184J/(g℃)×100g×6.75℃=2.8224kJ,即生成0.05mol的水放出热量2.8224kJ,所以生成1mol的水放出热量为2.8224kJ×20=56.5kJ,即该实验测得的中和热△H=-56.5kJ/mol;
(7)a.装置保温、隔热效果差,热量损失大,测得的热量偏小,中和热的数值偏小,故选a;
b.量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量偏高,中和热的数值偏大,故不选b;
c.分多次把NaOH溶液倒入盛有盐酸的小烧杯中,热量损失大,测得的热量偏小,中和热的数值偏小,故选c;
d.用温度计测定NaOH溶液起始温度后直接测定HCl溶液的温度,HCl溶液的起始温度偏高,测得的热量偏小,中和热的数值偏小,故选d。
II. (1)KMnO4酸性溶液与H2C2O4溶液发生氧化还原反应生成硫酸钾、硫酸锰、二氧化碳,反应的方程式是2KMnO4+5H2C2O4+3H2SO4==K2SO4+2MnSO4+10CO2↑+8H2O;
(2)实验A和C中KMnO4、H2C2O4、硫酸浓度相同、温度相同,只有催化剂不同,所以实验A和C探究的是催化剂对反应速率的影响;
(3)研究温度对化学反应速率的影响,应保证除温度外的其它变量都相同,实验A、E,只有温度不同,所以如果研究温度对化学反应速率的影响,使用实验A和E;
(3)实验A和B,草酸的体积不同,可研究草酸浓度对反应速率的影响,根据控制变量法,B加少量蒸馏水确保两实验中总体积相等,所以V1 =4 mL;
(5)A、C相比,C使用催化剂,反应速率A<C;A、B相比,A中草酸的浓度大于B,反应速率A>B,B反应速率最慢,溶液褪色所用的时间最长的是B组实验。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某气体的摩尔质量为Mg/mol,现有该气体mg, 用NA表示阿伏加德罗常数,求下列量:
①该气体的物质的量为______________mol;
②该气体在标准状况下的体积为_________________L;
③该气体在标准状况下的密度为_________________g/L;
④该气体一个分子的质量为_________________g;
⑤该气体m g完全溶解于水(气体与水不反应),得到100mL溶液,所得溶液的物质的量浓度为___mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用双线桥分析下列氧化还原反应,并按要求填空。2Al+3H2SO4 =Al2(SO4)3+3H2↑_______
(1)氧化剂:________,氧化产物:________;
(2)标准状况下,生成3.36L H2,参加反应的Al的质量是_______,转移的电子的物质的量为_____,若溶液中H2SO4的物质的量浓度为1.5 mol/L,则恰好完全反应需加入的H2SO4溶液的体积_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y两根金属棒插入Z溶液中构成如图所示装置,实验中电流表指针发生偏转,同时X棒变粗,Y棒变细,则X、Y、Z可能是下列中的( )

编号 | X | Y | Z |
A | Zn | Cu | 稀硫酸 |
B | Cu | Zn | 稀硫酸 |
C | Cu | Ag | 硫酸铜溶液 |
D | Ag | Zn | 硝酸银溶液 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个体积均为 1.0L的恒容密闭容器中发生反应:2CH3OH(g) CH3OCH3(g) + H2O(g) 下列说法正确的是( )
容器 编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
I | 387 | 0.20 | 0.080 | 0.080 |
II | 387 | 0.40 | ||
III | 207 | 0.20 | 0.090 | 0.090 |
A. 该反应的正反应为吸热反应
B. 达到平衡时,容器I中的CH3OH体积分数比容器II中的小
C. 容器I中反应到达平衡所需时间比容器III的长
D. 若起始时向容器I中充入0.15mol 的CH3OH、0.15mol 的CH3OCH3和0.10mol 的H2O,则反应将向正反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二茂铁[Fe(C5H5)2]可作为燃料的节能消烟剂、抗爆剂。二茂铁的电化学制备装置与原理如图所示,下列说法正确的是
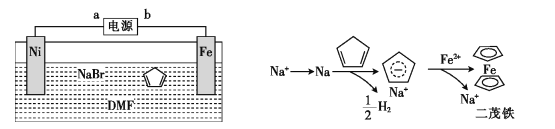
A.a为电源的正极
B.电解质溶液是NaBr水溶液和DMF溶液的混合液
C.电解池的总反应化学方程式为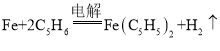
D.二茂铁制备过程中阴极的电极反应为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热还原法制备MgO材料的原理为MgSO4(s)+CO(g)![]() MgO(s)+SO2(g)+CO2(g) △H>0,T℃时,在一恒容密闭容器中加入一定量的MgSO4(s)和CO(g),一段时间后达到平衡状态。下列说法正确的是( )
MgO(s)+SO2(g)+CO2(g) △H>0,T℃时,在一恒容密闭容器中加入一定量的MgSO4(s)和CO(g),一段时间后达到平衡状态。下列说法正确的是( )
A. 活化能:E正>E逆
B. 其他条件不变,加入催化剂,△H减小
C. 其他条件不变,降低温度,化学平衡常数增大
D. 其他条件不变,向容器中通入Ar(g),平衡逆向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ni元素在生产、生活中有着广泛的应用。 回答下列问题:
(1)基态Ni原子价层电子的排布式为 ____。
(2)科学家在研究金属矿物质组分的过程中,发现了Cu-Ni-Fe等多种金属互化物。确定某种金属互化物是晶体还是非晶体最可靠的科学方法是对固体进行_____。
(3)Ni能与类卤素(SCN)2反应生成Ni(SCN)2。Ni(SCN)2中,第一电离能最大的元素是____;(SCN)2分子中,硫原子的杂化方式是____ ,σ键和π键数目之比为_____。
(4)[Ni(NH3)6](NO3)2中,不存在的化学键为____ (填标号)。
a.离子键 b.金属键 c.配位键 d.氢键
(5)镍合金储氢的研究已取得很大进展。
①图甲是一种镍基合金储氢后的晶胞结构示意图。 该合金储氢后,含1molLa的合金可吸附H2的数目为_____。
②Mg2NiH4是一种贮氢的金属氢化物。在Mg2NiH4晶胞中,Ni原子占据如图乙的顶点和面心,Mg2+ 处于乙图八个小立方体的体心。Mg2+位于Ni原子形成的 ___ (填“八面体空隙”或“四面体空隙”)。 若晶体的密度为dg/cm3,Mg2NiH4的摩尔质量为Mg/mol,则Mg2+和Ni原子的最短距离为 ___ nm(用含d、M、NA 的代数式表示)。
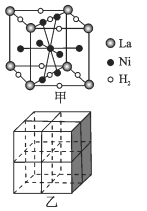
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学做“FeSO4被HNO3氧化”的实验,发现溶液变深棕色。猜想可能是生成的NO2或NO与Fe2+或Fe3+反应,使溶液变为深棕色,设计下列装置探究。下列说法错误的是
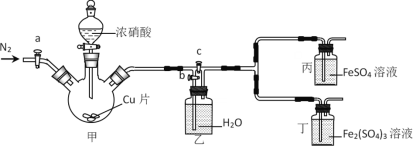
A.先检查装置气密性,加入药品后,关闭c,打开a和b,再通入一段时间N2
B.关闭a、c,打开b及分液漏斗活塞,反应后丙中溶液变为深棕色,丁中溶液无明显变化,证明NO与Fe2+反应
C.甲中反应一段时间后,更新丙、丁中试剂,关闭a和b,打开c,反应后丙中溶液变为深棕色,丁中溶液无明显变化,证明NO2也可与Fe2+反应
D.该实验的缺陷是缺少尾气吸收装置
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com