
����Ŀ��ijͬѧ����FeSO4��HNO3��������ʵ�飬������Һ������ɫ��������������ɵ�NO2��NO��Fe2+��Fe3+��Ӧ��ʹ��Һ��Ϊ����ɫ���������װ��̽��������˵���������
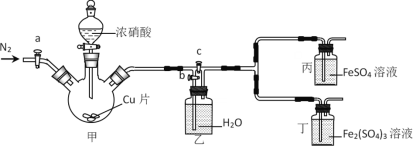
A.�ȼ��װ�������ԣ�����ҩƷ�ر�c����a��b����ͨ��һ��ʱ��N2
B.�ر�a��c����b����Һ©����������Ӧ�������Һ��Ϊ����ɫ��������Һ�����Ա仯��֤��NO��Fe2+��Ӧ
C.���з�Ӧһ��ʱ����±��������Լ����ر�a��b����c����Ӧ�������Һ��Ϊ����ɫ��������Һ�����Ա仯��֤��NO2Ҳ����Fe2+��Ӧ
D.��ʵ���ȱ����ȱ��β������װ��
���𰸡�C
��������
A���ȼ��װ�������ԣ�����ҩƷ��Ϊ��ֹװ���е�����Ӱ��ʵ��������ر�c����a��b��ͨ��һ��ʱ�䵪������װ���ڵĿ����ž�����A��ȷ��
B���ر�a��c����b����Һ©��������Ũ������Cu��Ӧ����NO2��NO2ͨ��ˮ����ˮ��Ӧ����NO��NO������Ͷ����к��������ӵ���Һ��Ϊ����ɫ�������������Ա仯��˵��NO��Fe2+��Ӧ����B��ȷ��
C�����з�Ӧһ��ʱ���Ũ�����ϡ�����ɵ���������NO�����Ըò�����֤��NO2�Ƿ���Fe2+��Ӧ����C����
D��ʵ����δ��Ӧ��NO2��NO����Ⱦ��������Ҫβ������װ�ã���D��ȷ��
�ʴ�ΪC��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I.50 mL 1.0mol��L��1�����50 mL 1.1 mol��L��1����������Һ��ͼ��ʾװ���н����кͷ�Ӧ����ͨ���ⶨ��Ӧ���������ų��������������к��ȡ��Իش��������⣺
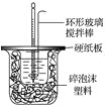
��1��__���������������������������β����������Ϊ���ν�������ͭ������
��2�����ձ����粻��Ӳֽ�壬������к�����ֵ��Ӱ����__������ƫ������ƫ����������Ӱ��������
��3���������60 mL 1.0 mol��L��1�����50 mL 1.1 mol��L��1����������Һ���з�Ӧ����������ʵ����ȣ���������__���������������������������������������к�����ֵ__����������������������������������
��4��__������������������������Ba��OH��2������������������������Һ��
��5��Q=cm��t������Q��ʾ���кͷ�Ӧ�ų���������m��ʾ��Ӧ����Һ��������c��ʾ��Ӧ������Һ�ı����ݣ���t��ʾ��Ӧǰ����Һ���¶ȵIJ�ֵ����ʵ��С����������ʵ�飬ÿ��ȡ��Һ��50 mL������¼����ԭʼ���ݣ�
ʵ����� | ��ʼ�¶�t1/�� | ��ֹ�¶�t2/�� | �²t2��t1��/�� |
1 | 25.0 | 32.6 | |
2 | 25.1 | 31.8 | |
3 | 25.1 | 31.9 |
��֪���ᡢNaOH��Һ�ܶȽ���Ϊ1.00 g��cm��3���кͺ���Һ�ı�����c=4.18410��3kJ��g��1������1��÷�Ӧ���к���Ϊ��H=__������С�����һλ����
��6������ʵ����ֵ�����57.3 kJ��mol��1��ƫ�����ƫ���ԭ�������__������ĸ����
a��ʵ��װ�ñ��¡�����Ч����
b����ȡNaOH��Һ�����ʱ���Ӷ���
c���ֶ�ΰ�NaOH��Һ����ʢ�������С�ձ���
d�����¶ȼƲⶨNaOH��Һ��ʼ�¶Ⱥ�ֱ�ӲⶨHCl��Һ���¶�
II. �������������������������ܹ�������Ӧ��
���� 0.1 mol/L KMnO4������Һ��0.5 mol/L H2C2O4��Һ���о���ͬ�����Ի�ѧ��Ӧ���ʵ�Ӱ�졣ʵ����̵����ݼ�¼����(������)�����ϱ�����Ϣ���ش��й����⣺
ʵ�� ��� | ��Ӧ�¶�/�� | �μӷ�Ӧ������ | |||||
KMnO4��H2SO4�� | H2C2O4 | H2O | MnSO4 | ||||
V/mL | c/mol��L��1 | V/mL | c/mol��L��1 | V/mL | G | ||
A | 20 | 10 | 0.1 | 10 | 0.5 | 0 | 0 |
B | 20 | 10 | 0.1 | 6 | 0.5 | V1 | 0 |
C | 20 | 10 | 0.1 | 10 | 0.5 | 0 | 1 |
D | 50 | 10 | 0.1 | 6 | 0.5 | 0 | 0 |
E | 40 | 10 | 0.1 | 10 | 0.5 | 0 | 0 |
��1��д����Ӧ�Ļ�ѧ����ʽ_____________________��
��2������о������Ի�ѧ��Ӧ���ʵ�Ӱ�죬ʹ��ʵ��________��________(��A��E��ʾ����ͬ)��
��3������о��¶ȶԻ�ѧ��Ӧ���ʵ�Ӱ�죬ʹ��ʵ��________��________��
��4��ʵ��A��B�������о�Ũ�ȶԻ�ѧ��Ӧ���ʵ�Ӱ�죬��V1 =_____��
��5��A��B��C����ʵ��Ƚϣ���Һ��ɫ���õ�ʱ�������__________��ʵ�顣
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ǿ�ѧ�Һϳɵ�һ�����Զ����������ڲ�ϸ���Ƶ��������ϣ��ϳ�·������ͼ��ʾ��
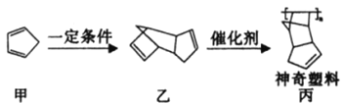
����˵���������
A.������Ӧ��������ɫ��ѧ���������ԭ�Ӿ���������
B.�ҵ�һ�ȴ�����10��(�����������칹)
C.��������ԭ���п��ܴ���ͬһƽ��
D.�ɼ������ҷ������Ǽӳɷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ŀǰ��ҵ�Ͽ�����CO��CO2������ȼ�ϼ״���ij�о�С��������йؼ״���ȡ��������ѧ��Ӧԭ������̽������֪�ڲ�ͬ�¶��µĻ�ѧ��Ӧƽ�ⳣ��(K1��K2��K3)�����ʾ����ش��������⣺
��ѧ��Ӧ | �ʱ� | ƽ�ⳣ�� | �¶�/�� | ||
500 | 700 | 800 | |||
��2H2(g)��CO(g) | ��H1 | K1 | 2.5 | 0.34 | 0.15 |
��CO2(g)��H2(g) | ��H2 | K2 | 1.0 | 1.70 | 2.52 |
��CO2(g)��3H2(g) | ��H3 | K3 | |||
��1����Ӧ����____(��������������������)��Ӧ��
��2�����ݷ�Ӧ����ڿ��Ƶ���K1��K2��K3֮��Ĺ�ϵ����K3=____(��K1��K2��ʾ)�����ݷ�Ӧ���ж���S___0(������������������������)����____(�����ϸ��������ϵ���)�¶��������ڸ÷�Ӧ�Է����С�
��3��500��ʱ����÷�Ӧ����ijʱ�̣�CO2(g)��H2(g)��CH3OH(g)��H2O(g)��Ũ�ȷֱ�Ϊ0.1mol/L��0.8mol/L��0.3mol/L��0.15mol/L�����ʱv(��)___v(��)(������������=����������)��
��4�����������������ʱ䣬����������ϵͼ��������_____
A. B.
B.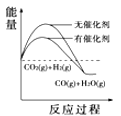 C.
C.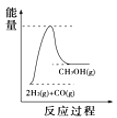 D.
D.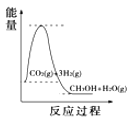
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ϊʲô������������������Ľṹ�й�(��ͼ)�������й�˵���������

A.��������Ĵ��ڣ�ˮ���ӵ��ȶ��Ժã�������Ҳ���ѷֽ�
B.��һ���̬���У�ˮ���Ӽ�ͨ������γɿռ���״�ṹ
C.�ڶ�����Һ�����У�ˮ���Ӽ��γ�����Ļ���ȹ�̬������
D.������һ���¶�ʱ����Һ�����е�ˮ�������²�����ӵ�������ѣ������������Ե�ˮ��������ʹ����们
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��SiO2��һ�ֻ���ԭ�ϣ������Ʊ�һϵ�����ʡ�����˵����ȷ����
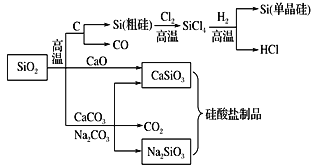
A.ͼ�����з�Ӧ��������������ԭ��Ӧ
B.�����εĻ�ѧ�����ȶ���������������ά
C.���������ȥʯӢɰ(��Ҫ�ɷ�ΪSiO2)��������̼���
D.��ͨ�������ɴ�������ʯӢ�Ƴɵģ����й̶����۵�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ������Cu����ŨH2SO4���Ȳ���SO2��������Ϊ2.24 L(��״����)����������������ܵ���(����)
A.����Cu������Ϊ6.4 g
B.�����ŨH2SO4�к�����0.2 mol
C.����Cu����������6.4 g
D.����ŨH2SO4�к����ʶ���0.2 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ�������װ����ȷ���ܴﵽĿ�ĵ��ǣ� ��
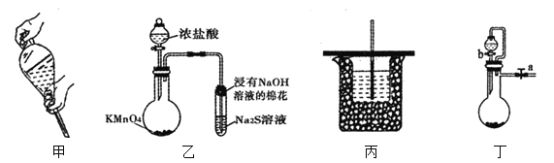
A.ͼ�ײ�������Һת������Һ©���У�������ȡ�������ϲ�����������ҡ
B.��װ���ҿɽ��бȽ�KMnO4��Cl2��S��������ǿ��
C.��װ�ñ��ɽ����к��ȵIJⶨ
D.��װ�ö����ر�a����b���ɼ���װ�õ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ��д����Ӧ���Ȼ�ѧ����ʽ����㷴Ӧ�ȣ�
��1����25����101kPa�£�1gҺ̬�״�ȼ������CO2��Һ̬ˮʱ�ų�22.5kJ��������÷�Ӧ���Ȼ�ѧ����ʽΪ_____��
��2����֪���з�Ӧ�ķ�Ӧ��Ϊ��
��CH3COOH��l��+2O2��g���T2CO2��g��+2H2O��l����H1=��880kJ/mol��
��C��s��+O2��g���TCO2��g����H2=��393 kJ/mol��
��H2��g��+![]() O2��g���TH2O��l����H3=��285.8kJ/mol
O2��g���TH2O��l����H3=��285.8kJ/mol
��Ӧ��C��s��+2H2��g��+CO2��g��=CH3COOH��l����H=_____kJmol��1��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com