
【题目】已知NA为阿伏加德罗常数的值,下列叙述错误的有几个( )
①BF3、CCl4中所有原子均达到最外层8电子稳定结构
②46g SiO2中含有共价键的数目为NA
③2g H218O和D2O的混合物中,含有的电子数为NA
④K2SO4溶于水的过程中有离子键、共价键的断裂
⑤78g Na2O2中所含离子的数目为4NA
⑥18g D2O的中子数小于10NA
⑦1mol NH5中含有5NA个N—H键(已知NH5中所有原子都达到稀有气体的稳定结构)
A.3B.4C.5D.6
【答案】C
【解析】
①BF3中B原子最外层只有6个电子,①错误;
②SiO2由原子构成,1mol SiO2中平均含4mol Si-O键,46g SiO2的物质的量为![]() ,含有共价键的物质的量为4×
,含有共价键的物质的量为4×![]() =
=![]() ,即含共价键数目为
,即含共价键数目为![]() NA,②错误;
NA,②错误;
③H218O和D2O的摩尔质量均为20g/mol,2g H218O和D2O的混合物的物质的量=![]() =0.1mol,每个H218O和D2O分子均含10个电子,故2g H218O和D2O的混合物所含电子的物质的量=0.1mol×10=1mol,即所含电子数为NA,③正确;
=0.1mol,每个H218O和D2O分子均含10个电子,故2g H218O和D2O的混合物所含电子的物质的量=0.1mol×10=1mol,即所含电子数为NA,③正确;
④K2SO4中K+和SO42-之间以离子键结合,溶于水电离出K+和SO42-,离子键断裂,无共价键断裂,④错误;
⑤Na2O2由Na+和O22-构成,78g Na2O2的物质的量为![]() =1mol,所以78g Na2O2中所含离子的物质的量=1mol×3=3mol,即含离子数目为3NA,⑤错误;
=1mol,所以78g Na2O2中所含离子的物质的量=1mol×3=3mol,即含离子数目为3NA,⑤错误;
⑥18g D2O的物质的量为![]() ,每个D2O分子的中子数=1×2+8×1=10,故18g D2O所含中子的物质的量为0.9mol×10=9mol,即中子数为9NA,小于10NA,⑥正确;
,每个D2O分子的中子数=1×2+8×1=10,故18g D2O所含中子的物质的量为0.9mol×10=9mol,即中子数为9NA,小于10NA,⑥正确;
⑦若1mol NH5中含有5NA个N—H键,则1和NH5分子中含5个N-H键,N原子最外层电子数为10,与NH5中所有原子都达到稀有气体的稳定结构矛盾,⑦错误;
综上所述,①②④⑤⑦错误,C满足题意。答案选C。


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:
【题目】从巴旦杏中提取有香味的有机物R,结构简式如图所示。下列有关R的说法错误的是
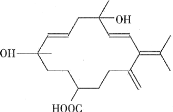
A.R既能与碳酸氢钠溶液反应,又能与钠粒反应
B.R能发生酯化、加成、氧化反应
C.R的羟基能在铜、加热条件下与O2反应生成醛基
D.R的分子式为C21H32O4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe、Co、Ni均为第Ⅷ族元素,它们的化合物在生产、生活中有着广泛的应用。
(1)基态Co原子的价电子排布式为_______,Co2+核外3d能级上有_____对成对电子。
(2)Co3+的一种配离子[Co(N3)(NH3)5]2+中,Co3+的配位数是________。1 mol配离子中所含σ键的数目为________,配位体N3-中心原子的杂化类型为________。
(3)Co2+在水溶液中以[Co(H2O)6]2+存在。向含Co2+的溶液中加入过量氨水可生成更稳定的[Co(NH3)6]2+,其原因是_________________________________________________。
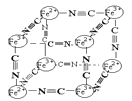
(4)某蓝色晶体晶体结构如图,Fe2+、Fe3+分别占据立方体互不相邻的顶点,而立方体的每条棱上均有一个CN-,K+位于立方体的体心上。据此可知该晶体的化学式为________,立方体中Fe2+间连接起来形成的空间构型是________。K+空缺率(体心中没有K+的占总体心的百分比)为_____________。
(5)NiO的晶胞结构如图甲所示,其中原子坐标参数A为(0,0,0),B为(1,1,0),则C原子坐标参数为________。
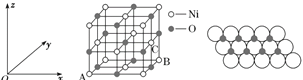
图甲 图乙
(6)一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充其中(如图乙),已知O2-的半径为a pm,每平方米面积上分散的该晶体的质量为________g(用含a、NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向27.2gCu和Cu2O的混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,生成NO和Cu(NO3)2,在所得溶液中加入1.0mol/L的NaOH溶液1.0L,此时溶液呈中性。金属离子已完全沉淀,沉淀质量为39.2g。下列有关说法不正确的是
A. Cu与Cu2O的物质的量之比为2∶1 B. 硝酸的物质的量浓度为2.6mol/L
C. 产生的NO在标准状况下的体积为4.48L D. Cu、Cu2O与硝酸反应后剩余HNO3为0.2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钠常用作漂白剂、杀菌剂、消毒剂,能与水和二氧化碳等物质发生反应,保存不当时容易变质。某实验小组以过氧化钠为研究对象进行了如下实验。
(1)探究一包Na2O2样品是否已经变质:取少量样品,将其溶解,加入__________溶液,充分振荡后有白色沉淀,证明Na2O2已经变质。
(2)该实验小组为了粗略测定过氧化钠的质量分数,称取了m g样品,并设计用下图装置来测定过氧化钠的质量分数。
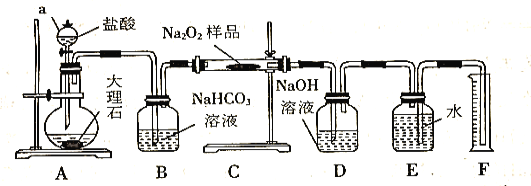
①装置D的作用是_________________________________;
②将仪器连接好以后,必须进行的第一步操作是_________________________________;
③写出装置C中发生主要反应的化学方程式_________________________________;
④反应结束后,在读取实验中生成气体的体积时,你认为合理的是_______________(填序号);
a.读取气体体积前,需冷却到室温
b.调整量筒使E、F内液面高度相同
c.视线与凹液面的最低点相平时读取量筒中水的体积
⑤读出量筒内水的体积后,将其折算成标准状况下氧气的体积为VmL,则样品中过氧化钠的质量分数为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增加。A是元素Y的单质。常温下,甲的浓溶液和A发生钝化。丙、丁、戊是由这些元素组成的二元化合物,且丙是无色气体。上述物质的转化关系如图所示。下列说法不正确的是( )
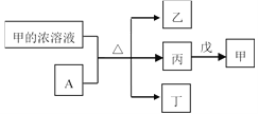
A.简单离子半径大小:X>Y
B.气态氢化物的还原性:X<Z
C.丁和戊中所含元素种类相同
D.W的简单离子与Z的简单离子在水溶液中可大量共存
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按第26届国际计量大会重新定义,阿伏加德罗常数(NA)有了准确值6.02214076×1023。下列说法正确的是( )
A.12gNaHSO4在熔融状态下可以电离出的阳离子数目0.1NA
B.用23.5gAgI与水制成的胶体中胶体粒子数目为0.1NA
C.标准状况下,2.24LCl2全部溶于水所得溶液中的Cl-与ClO-数目之和为0.2NA
D.1.0L18.4mol/LH2SO4溶液与足量铜在加热的条件下反应,被还原的H2SO4分子数目为9.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是极易溶于水且不与水发生化学反应的黄绿色气体,沸点为11℃,某小组在实验室中制备ClO2所用装置如图:[已知:SO2+2NaClO3+H2SO4=2ClO2+2NaHSO4]。
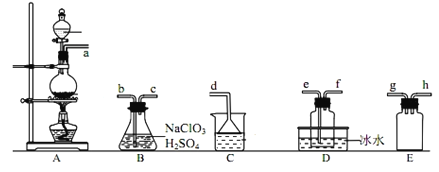
下列说法正确的是( )
A.装置C中装的是饱和食盐水,a流出气体为SO2
B.装置D放冰水的目的是液化二氧化硫防止污染环境
C.连接装置时,导管口a可接h或g,导管口c接e
D.可以选用装置A利用3mo/L盐酸与MnO2反应制备氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(13分)用辉铜矿(主要成分为 Cu2S,含少量Fe2O3、SiO2,等杂质)制备难溶于水的碱式碳酸铜的流程如下:
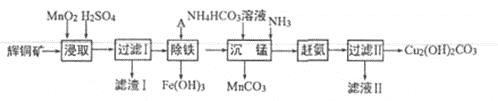
(1)下列措施是为了加快浸取速率,其中无法达到目的的是____(填字母)。
A.延长浸取时间 | B.将辉铜矿粉碎 |
C.充分搅拌 | D.适当增加硫酸浓度 |
(2)滤渣I巾的主要成分是MnO2、S、SiO2,请写出“浸取”反应中生成S的离子方程式:_______。
(3)研究发现,若先除铁再浸取,浸取速率明显变慢,可能的原因是___________。
(4)“除铁”的方法是通过调节溶液pH,使Fe3+转化为Fe(OH)3,则加入的试剂A可以是_______(填化学式);“赶氨”时,最适宜的操作方法是________。
(5)“沉锰”(除Mn2+)过程中有关反应的离子方程式为_______。
(6)滤液Ⅱ经蒸发结晶得到的盐主要是___________(填化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com