
【题目】(13分)用辉铜矿(主要成分为 Cu2S,含少量Fe2O3、SiO2,等杂质)制备难溶于水的碱式碳酸铜的流程如下:
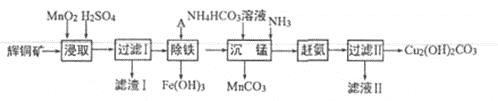
(1)下列措施是为了加快浸取速率,其中无法达到目的的是____(填字母)。
A.延长浸取时间 | B.将辉铜矿粉碎 |
C.充分搅拌 | D.适当增加硫酸浓度 |
(2)滤渣I巾的主要成分是MnO2、S、SiO2,请写出“浸取”反应中生成S的离子方程式:_______。
(3)研究发现,若先除铁再浸取,浸取速率明显变慢,可能的原因是___________。
(4)“除铁”的方法是通过调节溶液pH,使Fe3+转化为Fe(OH)3,则加入的试剂A可以是_______(填化学式);“赶氨”时,最适宜的操作方法是________。
(5)“沉锰”(除Mn2+)过程中有关反应的离子方程式为_______。
(6)滤液Ⅱ经蒸发结晶得到的盐主要是___________(填化学式)。
【答案】(1)A (2)2MnO2+Cu2S+8H+=S+2Cu2++2Mn2++4H2O (3)Fe3+可催化Cu2S被MnO2氧化
(4)CuO或Cu(OH)2;将溶液加热 (5)Mn2++HCO3-+NH3=NH4++MnCO3↓ (6)(NH4)2SO4
【解析】
试题(1)增大反应物的接触面积或升高温度等均可以增大反应速率,所以酸浸时,通过粉碎矿石或者升高温度或者进行搅拌都可以提高浸取率,但延长浸取时间并不能提高速率,答案选A。
(2)在酸性条件下MnO2氧化Cu2S得到硫沉淀、CuSO4、MnSO4和水,所以该反应的离子方程式是2MnO2+Cu2S+8H+=S+2Cu2++2Mn2++4H2O。
(3)由于Fe3+可催化Cu2S被MnO2氧化,所以若先除铁再浸取,浸取速率明显变慢。
(4)由于除杂时不能再引入新的杂质,所以加入的试剂A可以是CuO或Cu(OH)2。氨气易挥发,则“赶氨”时,最适宜的操作方法是将溶液加热。
(5)根据原子守恒可知“沉锰”(除Mn2+)过程中除了生成碳酸锰外还有铵盐生成,则有关反应的离子方程式为Mn2++HCO3-+NH3=NH4++MnCO3↓。
(6)滤液Ⅱ中含有硫酸铵,因此经蒸发结晶得到的盐主要是(NH4)2SO4。


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:
【题目】已知NA为阿伏加德罗常数的值,下列叙述错误的有几个( )
①BF3、CCl4中所有原子均达到最外层8电子稳定结构
②46g SiO2中含有共价键的数目为NA
③2g H218O和D2O的混合物中,含有的电子数为NA
④K2SO4溶于水的过程中有离子键、共价键的断裂
⑤78g Na2O2中所含离子的数目为4NA
⑥18g D2O的中子数小于10NA
⑦1mol NH5中含有5NA个N—H键(已知NH5中所有原子都达到稀有气体的稳定结构)
A.3B.4C.5D.6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. 25 ℃时0.1molL﹣1NH4Cl溶液的Kw大于100℃时0.01molL﹣1NaCl溶液的Kw
B. 常温下,pH均为3的醋酸和硫酸铝两种溶液中,由水电离出的氢离子浓度之比为1∶108
C. 根据溶液的pH与酸碱性的关系,推出pH=6.5的溶液一定显酸性
D. 室温下,将pH=2的盐酸与pH=12的氨水等体积混合,溶液显中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
a | b | ||||||||||||||||
[ | c | d | e | f | |||||||||||||
g | h | i | j | k | l | m | |||||||||||
n | o |
请根据要求用元素符号或化学式回答下列问题:
(1)表中所列元素中,原子最外层有2个电子的元素为_________。
(2)画出d元素原子的结构示意图_______________________________,其气态氢化物溶于水显_____________性。(填“酸”或“碱”)
(3)比较元素g和元素h形成的最高价氧化物的水化物的碱性强弱________>__________。
(4)表中j元素在元素周期表中的位置是______________________。
(5)表中所列元素中,最高价氧化物对应水化物碱性最强的是___________(填写化合物的化学式,下同),具有两性的是_____________,
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】⑴在①NaCl、②NaOH、③N2、④H2S、⑤Na2O2中,只含有离子键的是________,只含有极性键的是______,既含离子键又含非极性共价键的是____。
(2)写出下列物质的电子式:
CO2____________NaCl____________ HClO_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是
A. 向0.1mol/LCH3COOH溶液中加入少量水,溶液中c(H+)/c(CH3COOH)减小
B. 将CH3COONa溶液从20℃升温至30℃,溶液中c(CH3COO-)/c(CH3COOH)·c(OH-)增大
C. 向盐酸中加入氨水至中性,溶液中c(NH4+)/c(Cl-)>1
D. 向AgCl、AgBr的饱和溶液中加入少量硝酸银,溶液中c(Cl-)/c(Br-)不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物的分子式为C5H11Cl,分析数据表明:分子中有两个—CH3、两个—CH2—、一个![]() 和一个—Cl,它的可能的结构有( )种
和一个—Cl,它的可能的结构有( )种
A.2B.3C.4D.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分子中中心原子的杂化方式和分子的空间构型均正确的是( )
A. C2H2:sp2、直线形
B. SO42-:sp3、三角锥形
C. H3O+:sp3、V形
D. BF3:sp2、平面三角形
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人们应用原电池原理制作了多种电池,以满足不同的需要。以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格。
(1)铅蓄电池在放电时发生的电池反应式为:Pb+PbO2+2H2SO4===2PbSO4+2H2O。负极电极反应式为___________________________________________。
(2)FeCl3溶液常用于腐蚀印刷电路铜板,发生2FeCl3+Cu===2FeCl2+CuCl2,若将此反应设计成原电池,则负极所用电极材料为________,当线路中转移0.2 mol电子时,则被腐蚀铜的质量为________g。
(3)燃料电池是一种高效、环境友好的供电装置,以甲醇做燃料的电池,如下图所示,

①负极反应物是______________,H+从________极到________极(填a或b)。
②正极反应式为_________________,负极反应式为___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com