


 核心素养学练评系列答案
核心素养学练评系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:
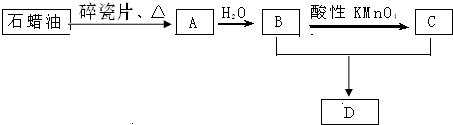
查看答案和解析>>
科目:高中化学 来源: 题型:
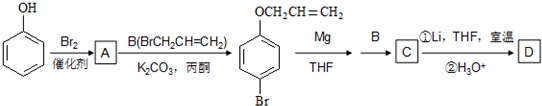
| Mg |
| THF |
| BrR2 |
| ①Li,THF,室温 |
| ②H3O+ |
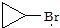 是化合物B的一种同分异构体,用1H核磁共振谱可以证明该化合物中有
是化合物B的一种同分异构体,用1H核磁共振谱可以证明该化合物中有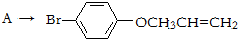 的有机反应类型:
的有机反应类型: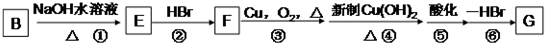
查看答案和解析>>
科目:高中化学 来源: 题型:
 实验设计:
实验设计:查看答案和解析>>
科目:高中化学 来源: 题型:
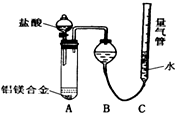 铝镁合金已成为轮船制造、化工生产等行业的重要材料.研究性学习小组的三位同学,为测定已知质量的铝镁合金(设不含其它元素)中镁的质量分数,设计下列三种不同实验方案(所加试剂均为足量)进行探究.填写下列空白.
铝镁合金已成为轮船制造、化工生产等行业的重要材料.研究性学习小组的三位同学,为测定已知质量的铝镁合金(设不含其它元素)中镁的质量分数,设计下列三种不同实验方案(所加试剂均为足量)进行探究.填写下列空白.| 盐酸 |
| 氢氧化钠溶液 |
| 氢氧化钠溶液 |
| 盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 最外层电子数 | 次外层电子数 |
| D | X | X+4 |
| E | X+1 | X+4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属钠溶于水:2Na+2H2O=2Na++2OH-+H2↑ |
| B、Cl2与H2O反应:Cl2+H2O=2H++Cl-+ClO- |
| C、硫酸铜溶液与氢氧化钡溶液反应:Cu2++2OH-=Cu(OH)2↓ |
| D、铁与稀硫酸反应:2Fe+6H+=2Fe3++3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
A、K=
| ||
B、K=
| ||
C、K=
| ||
D、K=
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com