
- 4 |
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
| 7-2 |
| 3-2 |


 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,32gO2占有的体积约为22.4L |
| B、氢气的摩尔质量是2g |
| C、在标准状况下,22.4L水的质量为18g |
| D、1molH2O的质量是18g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、丙烯的结构简式:C3H6 |
B、3-甲基-1-丁烯的结构简式: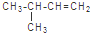 |
C、HOCH2COOH缩聚物的结构简式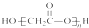 |
D、苯甲醛: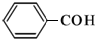 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③⑦ | B、②⑥⑦ |
| C、①③④ | D、③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
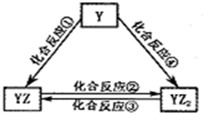 X、Z、Q、R 4种短周期元素的原子序数依次增大,Y是一种短周期主族非金属元素.化合物甲由X、Z、Q 3种元素组成,常温下,0.1mol?L-1甲溶液的pH=13.工业上常用电解QR饱和溶液生产甲.请填写下列空白.
X、Z、Q、R 4种短周期元素的原子序数依次增大,Y是一种短周期主族非金属元素.化合物甲由X、Z、Q 3种元素组成,常温下,0.1mol?L-1甲溶液的pH=13.工业上常用电解QR饱和溶液生产甲.请填写下列空白.查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素编号 | 元素特征信息 |
| A | 其单质是密度最小的物质 |
| B | 阴离子带两个单位负电荷,单质是空气的主要成分之一 |
| C | 其阳离子与B的阴离子有相同的电子层结构, 且与B可以形成两种离子化合物 |
| D | 其氢氧化物和氧化物都有两性,与C同周期 |
| E | 与C同周期,原子半径在该周期最小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①④⑥ | B、①③⑤ |
| C、①③⑤⑥ | D、③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
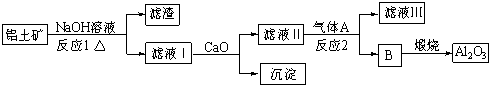
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com