
【题目】四种短周期元素A、B、C、D原子序数依次增大。A、B、C三种元素原子核外电子层数之和是5。A、B两种元素原子最外层电子数之和等于C元素原子最外电子层上的电子数;B元素原子最外电子层上的电子数是它电子层数的2倍,A和C可以形成化合物CA3,B与D的原子序数之比为3∶4。请回答:
(1)化合物CA3的化学式是__________。
(2)写出A和C化合生成CA3反应的平衡常数表达式_________。在一定条件下要使该反应平衡向右移动,可采取的措施有________。
A 缩小反应容器容积 B 增大反应容器容积
C 使用合适的催化剂 D 及时分离出生成物
(3)由四种元素中的三种元素组成的物质甲属于盐类,其水溶液呈酸性,请用离子方程式表示其呈酸性的原因__________,若用pH试纸测定0.1 mol/L的甲溶液的pH,实验操作是__________
(4)乙和丙为含有上述四种元素的常见无机盐,二者均既可与盐酸又可与烧碱溶液反应。则乙和丙的化学式为乙:___________;丙__________。
(5)写出乙溶液与硫酸氢钠溶液反应的离子方程式_________。
【答案】NH3 ![]() A、D NH4++H2O
A、D NH4++H2O![]() NH3·H2O+H+ 用玻璃棒蘸取溶液滴在pH试纸上,并与标准比色卡对比 NH4HCO3 (NH4)2CO3 H++ HCO3-=CO2↑+H2O或2H++ CO32-=CO2↑+H2O
NH3·H2O+H+ 用玻璃棒蘸取溶液滴在pH试纸上,并与标准比色卡对比 NH4HCO3 (NH4)2CO3 H++ HCO3-=CO2↑+H2O或2H++ CO32-=CO2↑+H2O
【解析】
B元素原子最外电子层上的电子数是它电子层数的2倍推出B为碳,B与D的原子序数之比为3∶4推出D为氧,四种短周期元素A、B、C、D原子序数依次增大,推出C为氮,A和C可以形成化合物CA3推出A为氢,据此分析。
B元素原子最外电子层上的电子数是它电子层数的2倍推出B为碳,B与D的原子序数之比为3∶4推出D为氧,四种短周期元素A、B、C、D原子序数依次增大,推出C为氮,A和C可以形成化合物CA3推出A为氢。
(1)化合物CA3的化学式是NH3;
(2)平衡常数等于生成物浓度幂之积比反应物浓度幂之积,故A和C化合生成CA3反应的平衡常数表达式![]() ;
;
反应N2(g)+3H2(g)2NH3(g) △=-QkJ/mol为气体体积缩小的放热反应;
A.缩小反应容器容积,压强增大,平衡向气体体积缩小的正反应方向移动,选项A正确; B. 增大反应容器容积,压强缩小,平衡向气体体积增大的逆反应方向移动,选项B错误;
C. 使用合适的催化剂,催化剂不能使平衡移动,选项C错误;
D. 及时分离出生成物,平衡向正反应方向移动,选项D正确;
答案选AD;
(3)由四种元素中的三种元素组成的物质甲NH4NO3属于强酸弱碱盐,水解呈酸性,用离子方程式表示其呈酸性的原因为NH4++H2O![]() NH3·H2O+H+,若用pH试纸测定0.1 mol/L的甲溶液的pH,实验操作是用玻璃棒蘸取溶液滴在pH试纸上,并与标准比色卡对比;
NH3·H2O+H+,若用pH试纸测定0.1 mol/L的甲溶液的pH,实验操作是用玻璃棒蘸取溶液滴在pH试纸上,并与标准比色卡对比;
(4)乙和丙为含有上述四种元素的常见无机盐,二者均既可与盐酸又可与烧碱溶液反应,则应为铵盐且为弱酸盐,则乙和丙的化学式为分别为NH4HCO3和(NH4)2CO3;
(5)乙溶液NH4HCO3或(NH4)2CO3与硫酸氢钠溶液反应的离子方程式为H++ HCO3-=CO2↑+H2O或2H++ CO32-=CO2↑+H2O。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】将O2和NH3的混合气体448mL通过加热的三氧化二铬(催化剂),充分反应后,再通过足量的水,最终收集到44.8mL O2。原混合气体中O2的体积可能是(假设氨全部被氧化;气体体积均已换算成标准状况)( )
A. 134.4mL B. 313.6mL C. 287.5mL D. 268.8mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】茶多酚是一类目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂的总称。其中没食子儿茶素(EGC)的结构如图所示。关于EGC的下列叙述中正确的是
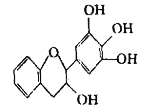
A.EGC是一种芳香烃
B.1molEGC与4molNaOH恰好完全反应
C.遇FeCl3溶液能不发生显色反应
D.易发生氧化反应和取代反应,相对较难发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W四种短周期元素的原子序数依次增大,其中X与Y、Z、W所形成的常见化合物(10e或18e)在常温下均为气态,在元素周期表中Z与W相邻,Y的最高价氧化物的水化物与其氢化物反应生成盐,且Y的核电荷数与W的外成层电子数相同。
(1)Z离子的结构示意图是_____________________________。
(2)X、Y、W可组成一种化合物,原子个数比为4:1:1,该化合物的化学式是_______,其中含有的化学键有__________________。
(3)X与Y所形成的分子的电子式为__________,它比同主族其他元素的氢化物沸点高的原因是__________________。
(4)请从Z、W的结构上说明Z、W两种元素非金属性的强弱_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表是元素周期表的一部分,根据所给的10种元素,完成以下各小题。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
2 | C | N | O | Ne | ||||
3 | Na | Mg | Al | Si | S | Cl |
(1)镁的原子结构示意图为___。
(2)H2SO4与HClO4中,酸性较强的是___。
(3)NaOH与Al(OH)3中,属于两性氢氧化物的是___。它常用作治疗胃酸(含盐酸)过多的药物,该反应的离子方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量的铁、氧化亚铁和氧化铁的混合粉末中,加入100ml2mol/L的盐酸,恰好使混合物完全溶解,并放出448ml的气体(SPT),在所得溶液中加入KSCN溶液无血红色出现.若用相同质量的上述混合物粉末高温下同足量的一氧化碳反应,可得到铁的质量是( )
A.无法计算B.2.8gC.5.6gD.11.2g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理研究化学反应有重要意义。
(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g) ![]() 2SO3(g),混合体系中SO3的百分含量和温度的关系如图1所示(曲线上任何一点都表示平衡状态)。
2SO3(g),混合体系中SO3的百分含量和温度的关系如图1所示(曲线上任何一点都表示平衡状态)。
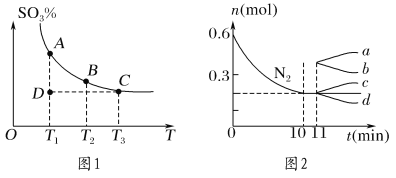
①若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡________(填“向左”“向右”或“不”)移动。
②若反应进行到状态D时,v逆 ________ (填“>”“<”或“=”)v正。
(2)课本里介绍的合成氨技术叫哈伯法:N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0,应用此法反应达到平衡时反应物的转化率不高。
2NH3(g) ΔH<0,应用此法反应达到平衡时反应物的转化率不高。
①能使该反应的反应速率增大,且平衡向正反应方向移动的措施是________(填编号)。
A.使用更高效的催化剂 B.增大压强
C.及时分离出氨气 D.升高温度
②若在某温度下,2 L的密闭容器中发生合成氨的反应,图2表示N2的物质的量随时间的变化曲线。用NH3表示0~10 min内该反应的平均速率v(NH3)=______________;从第11 min起,升高温度,则n(N2)的变化曲线为________(填编号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将3molSO2和1 molO2充入一定容密闭容器中,在催化剂存在下进行下列反应:2SO2(g)+ O2(g)![]() 2SO3(g) △H=-197kJ/ mol,当达到平衡状态时,下列说法中正确的是
2SO3(g) △H=-197kJ/ mol,当达到平衡状态时,下列说法中正确的是
A.SO2与O2的转化率可能相等
B.容器中一定存在n(SO2)>1mol且n(SO3)<2mol
C.放出的热量为197kJ
D.当O2的转化率为50%时SO2和SO3 的物质的量一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸(H3PO4)是一种中强酸,常温下,H3PO4水溶液中含磷微粒的分布分数(平衡时某微粒的浓度占各含磷微粒总浓度的分数)与pH的关系如图,下列说法正确的是( )


A.H3PO4的电离方程式为:H3PO4![]() 3H++PO43-
3H++PO43-
B.pH=2时,溶液中大量存在的微粒有:H3PO4、H2PO4-、HPO42-、PO43-
C.滴加NaOH溶液至pH=7,溶液中c(Na+)=c(H2PO4-)+2c(HPO42-)+3c(PO43-)
D.滴加少量Na2CO3溶液,3Na2CO3+2H3PO4=2Na3PO4+3H2O+3CO2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com