
【题目】茶多酚是一类目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂的总称。其中没食子儿茶素(EGC)的结构如图所示。关于EGC的下列叙述中正确的是
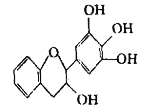
A.EGC是一种芳香烃
B.1molEGC与4molNaOH恰好完全反应
C.遇FeCl3溶液能不发生显色反应
D.易发生氧化反应和取代反应,相对较难发生加成反应
科目:高中化学 来源: 题型:
【题目】下列装置为锂钒氧化物二次电池,其成本较低,且对环境无污染:V2O5+xLi![]() LixV2O5;在图中用该电池电解含镍酸性废水可得到单质镍。下列说法正确的是
LixV2O5;在图中用该电池电解含镍酸性废水可得到单质镍。下列说法正确的是
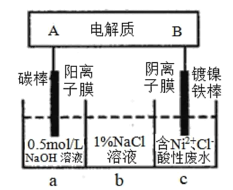
A.该电池充电时,B电极的电极反应式为:LixV2O5-xe-=V2O5+xLi+
B.锂钒氧化物二次电池可以用LiCl水溶液作为电解液
C.电解过程中,b中NaCl溶液的物质的量浓度会增大
D.当锂钒氧化物二次电池中有7gLi参与放电时,转移电子数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】.甲胺铅碘(CH3NH3PbI3)可用作全固态钙钛矿敏化太阳能电池的敏化剂,该物质可由甲胺(CH3NH2)、PbI2 及 HI 为原料来合成。请回答下列问题:
(1)制取甲胺的反应为 CH3OH(g)+NH3(g)==CH3NH2(g)+H2O(g),已知该反应中相关化学键的键能数据如下表所示:
共价键 | C-O | H-O | N-H | C-N |
键能/(kJ | 351 | 463 | 393 | 293 |
则该反应的△H=_____kJ·mol-1
(2)工业上利用水煤气合成甲醇的反应为 CO(g)+2H2(g) ![]() CH3OH(g) △H<0。一定温度下, 向体积为 2L 的密闭容器中加入 CO 和 H2,5min 末反应达到化学平衡状态,测得各组分浓度如下表所示。
CH3OH(g) △H<0。一定温度下, 向体积为 2L 的密闭容器中加入 CO 和 H2,5min 末反应达到化学平衡状态,测得各组分浓度如下表所示。
物质 | CO | H2 | CH3OH |
浓度/(mol | 0.9 | 1.0 | 0.6 |
①0~5min 内,用 CO 表示的平均反应速率为_____。
②既能加快反应速率,又能提高氢气转化率的措施有_____(答一条即可)。
③能说明上述反应已达化学平衡状态的是_____(填字母)。
A.v正 (CO)=2v逆 (H2)
B.混合气体密度保持不变
C.反应容器内压强保持不变
D.混合气体的平均摩尔质量不变
(3)PbI2 可由 Pb3O4 和 HI 反应制备,反应的化学方程式为_____。
(4)常温下 PbI2 饱和溶液中 c(I-)=2.0×10-3mol·L-1,则 Ksp(PbI2)=________;已知Ksp(PbS)=4.0×10-28,则反应 PbI2(s)+2-(aq) ![]() PbS(s)+2I-(aq)的平衡常数K=_______________________。
PbS(s)+2I-(aq)的平衡常数K=_______________________。
(5)HI 的分解反应曲线和液相法制备 HI 的反应曲线分别如图 1 和图 2 所示:
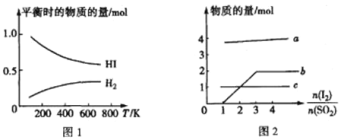
①反应 H2(g)+I2(g)![]() 2HI(g)的△H__________(填“>”或“<")0。
2HI(g)的△H__________(填“>”或“<")0。
②将 SO2 通入碘水中会发生反应:SO2+I2+2H2O==4H++SO42-+2I-,I2+I- ![]() I3-。图 2 中曲线 b 所代表的微粒是_____(填微粒符号)。
I3-。图 2 中曲线 b 所代表的微粒是_____(填微粒符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组对人教版教材实验“在200mL烧杯中放入20g蔗糖(C12H22O11),加入适量水,搅拌均匀,然后再加入15mL质量分数为98%浓硫酸,迅速搅拌”进行如下探究;
(1)观察现象:蔗糖先变黄,再逐渐变黑,体积膨胀,形成疏松多孔的海绵状黑色物质,同时闻到刺激性气味,按压此黑色物质时,感觉较硬,放在水中呈漂浮状态,同学们由上述现象推测出下列结论:
①浓硫酸具有强氧化性 ②浓硫酸具有吸水性 ③浓硫酸具有脱水性④浓硫酸具有酸性 ⑤黑色物质具有强吸附性
其中依据不充分的是_________(填序号);
(2)为了验证蔗糖与浓硫酸反应生成的气态产物,同学们设计了如下装置:

试回答下列问题:
①图1的A中最好选用下列装置_________(填编号);
②图1的 B装置所装试剂是_________;D装置中试剂的作用是_________;E装置中发生的现象是_________;
③图1的A装置中使蔗糖先变黑的化学反应方程式为_________,后体积膨胀的化学方程式为:_________;
④某学生按图2进行实验时,发现D瓶品红不褪色,E装置中有气体逸出,F装置中酸性高锰酸钾溶液颜色变浅,推测F装置中酸性高锰酸钾溶液颜色变浅的原因_________,其反应的离子方程式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关溶液性质的叙述,正确的是 ( )
A.室温时饱和的二氧化碳水溶液,冷却到0℃时会放出一些二氧化碳气体
B.20℃,100g水可溶解34.2g KCl,此时KCl饱和溶液的质量分数为34.2%
C.强电解质在水中溶解度一定大于弱电解质
D.相同温度下,把水面上的空气换成相同压力的纯氧,100g水中溶入氧气的质量增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方程式书写正确的是( )
A.NaHCO3在水溶液中的电离方程式:NaHCO3=Na++H++CO32-
B.H2S的电离方程式:H2S+H2O![]() H3O++HS-
H3O++HS-
C.CO32-的水解方程式:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
D.HS-的水解方程式:HS-+H2O![]() S2-+H3O+
S2-+H3O+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属铝在生产生活中有广泛用途。
(1)铝元素在元素周期表中位于______________。
(2)用化学方程式表示工业制备铝单质______________。 铝热反应可用于焊接钢轨,下图为铝热反应的实验装置图。
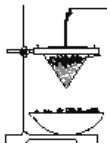
(3) 该铝热反应的化学方程式是______________。铝热反应的反应现象说明反应物的总能量___________生成物的总能量(填“<”、“>”或“=”)。
(4)铝热反应在工业上用于冶炼______________金属(填编号)。
A. 强还原性 B. 难熔性 C. 易导电 D. 活泼
(5)反应结束后,从沙中取出生成的固体物质,有同学推测该固体是铁铝合金,他设计了如下实验证明此 固体中含有金属铝:取少量固体于试管中,滴加______________,当观察到______________现象时,证明固体中含有金属铝。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素A、B、C、D原子序数依次增大。A、B、C三种元素原子核外电子层数之和是5。A、B两种元素原子最外层电子数之和等于C元素原子最外电子层上的电子数;B元素原子最外电子层上的电子数是它电子层数的2倍,A和C可以形成化合物CA3,B与D的原子序数之比为3∶4。请回答:
(1)化合物CA3的化学式是__________。
(2)写出A和C化合生成CA3反应的平衡常数表达式_________。在一定条件下要使该反应平衡向右移动,可采取的措施有________。
A 缩小反应容器容积 B 增大反应容器容积
C 使用合适的催化剂 D 及时分离出生成物
(3)由四种元素中的三种元素组成的物质甲属于盐类,其水溶液呈酸性,请用离子方程式表示其呈酸性的原因__________,若用pH试纸测定0.1 mol/L的甲溶液的pH,实验操作是__________
(4)乙和丙为含有上述四种元素的常见无机盐,二者均既可与盐酸又可与烧碱溶液反应。则乙和丙的化学式为乙:___________;丙__________。
(5)写出乙溶液与硫酸氢钠溶液反应的离子方程式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.25℃时NH4Cl溶液的KW大于100℃时NH4Cl溶液的KW
B.将浓度为0.1 mol·L-1HF溶液加水不断稀释,c(H+)/c(HF)保持不变
C.加入铝粉能产生氢气的溶液中,可能存在大量的Na+、Ba2+、AlO2-、NO3-
D.100℃时,将pH=2的盐酸与pH=12的NaOH溶液等体积混合,溶液显中性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com