
【题目】下列有关物质性质的描述和该性质的应用均正确的是( )
A.氨气具有氧化性,用浓氨水检验氯气管道是否泄漏
B.氢氟酸具有强酸性.用氢氟酸蚀刻玻璃
C.二氧化硫具有还原性,用二氧化硫水溶液吸收溴蒸气
D.铜的金属活动性比铝弱,可用铜罐代替铝罐贮运浓硝酸
科目:高中化学 来源: 题型:
【题目】尿素(H2NCONH2)是一种农业生产中常用的氮肥。在工业上,尿素还用于制造有机铁肥,如[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(III)]。回答下列问题:
(1)基态Fe3+的核外价电子排布式为 。
(2)C、N、O三种元素的第一电离能由大到小的顺序是 。
(3)在一定条件下,NH3与CO2能合成尿素,1mol尿素分子中,σ键的数目为 ;尿素分子中C原子的杂化方式为 。
(4)NO3-的空间构型为 ;写出NO3-互为等电子体的一种分子的化学式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数值。下列有关叙述正确的是
A.14g乙烯和丙烯混合气体中的氢原子数为2 NA
B.1molFe溶于过量硝酸,电子转移数为2NA
C.18g水中含有2NA个氢键
D.标准状况下,2.24LCCl4含有的共价键数为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在①乙醇与氧气在铜催化下反应;②淀粉在稀硫酸作用下在水中加热;③葡萄糖与钠反应;④乙醇一定条件下与乙酸反应中,不包括的反应类型是
A.氧化反应 B.加成反应 C.酯化反应 D.水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A. 0.1 mol·L-1NaOH溶液:K+、Na+、SO42-、CO32-
B. 0.1 mol·L-1Na2CO3溶液:K+、Ba2+、NO3-、Cl-
C. 0.1 mol·L-1FeCl3溶液:K+、NH4+、I-、SCN-
D.  =1×1014的溶液:Ca2+、Na+、ClO-、NO3-
=1×1014的溶液:Ca2+、Na+、ClO-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)![]() 2SO3(g)△H<0,是工业制硫酸的主要反应之一。
2SO3(g)△H<0,是工业制硫酸的主要反应之一。
(1)该反应过程的能量变化如图所示:

E的大小对该反应的反应热有无影响_______ (填“有”或“无”),该反应通常有V2O5作催化剂,加入V2O5后,改变的是图中的_____。
A.△H B.E C.△H-E D.△H+E
(2)某温度下,甲同学将2molSO2和1molO2置于密闭容器中,反应达平衡后,SO2平衡转化率(α)与体系总压强(p)的关系如图①所示,若A点二氧化硫的平衡浓度为0.04mol/L,则容器的体积为__L;图①中B点SO2、O2、SO3的平衡浓度之比为_________;反应达到平衡时,时间t1时缩小容器体积,请在图②中画出时间t1之后反应速率变化图像;图③为压强等于0.5MPa时不同温度下SO2转化率与温度关系图,图中T2___T1(填写“大于”或“小于”)

(3)在2L的密闭容器中,乙同学投入2molSO2和bmolO2;25min时达到平衡,如下图所示,在35min时,改变某一条件,经过一段时间后,70min时,反应再次达到平衡,回答下列问题:

①10min时,v(SO2) ______
②求0~10min时,v(O2)=_______
③反应开始至35min时,测得反应共放热138.6kJ,则反应2SO2(g)+O2(g)==2SO3(g)△H=_________kJ/mol
④35min时,改变的条件可能是______
A.加入更多的V2O5
B.从容器中分离出少量O2
C.投入一定量的SO3
D.降低反应温度
E.往容器中加入N2,使容器压强增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇燃料电池的总反应为:2CH3OH +3O2= 2CO2 ↑+ 4H2O,下图是该电池的示意图。下列说法正确的是
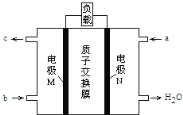
A.a 是氧气,b 是甲醇
B.质子从 N 电极区穿过质子交换膜移向 M 电极区
C.正极反应为:O2 +2H2O + 4e- = 4 OH-
D.当电路中有 3 mole- 转移时,电池中n(H+)变化为 0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com