
【题目】固体粉末可能由SiO2、Al、(NH4)2SO4、MgCl2、FeCl2、AlCl3中的一种或几种组成,某学习小组对该固体进行了如下实验。下列判断正确的是( )

A. 气体甲一定能使湿润的红色石蕊试纸变蓝
B. 白色沉淀甲可能是纯净物也可能是混合物
C. 无色溶液乙和无色溶液丙混合一定有无色气体生成,可能有白色沉淀生成
D. 该粉末中一定存在AlCl3、(NH4)2SO4、MgCl2,一定不存在FeCl2
【答案】C
【解析】
固体X与过量浓NaOH溶液反应生成气体甲,该气体可能为氢气或氨气,因为Al、(NH4)2SO4都能与NaOH反应分别生成氢气和氨气,且两种气体通过碱石灰后体积都不会发生变化;
生成的无色溶液甲中通入过量二氧化碳后,生成了无色溶液乙和白色沉淀乙,白色沉淀乙溶于盐酸,则白色沉淀乙只能为氢氧化铝,是偏铝酸根离子与二氧化碳反应生成的,所以无色溶液甲中含AlO2-,不含SiO32-,偏铝酸根可能是Al或氯化铝反应生成的;
固体粉末与NaOH还生成的白色沉淀甲,沉淀甲久置无变化,则固体X中一定不含FeCl2,氢氧化亚铁沉淀的颜色会发生变化,一定含有MgCl2,以此解答该题。
A. 由以上分析知,气体甲可能是NH3也可能是H2,若气体甲为氨气,则能使湿润的红色石蕊试纸变蓝,若为氢气,则不能使湿润的红色石蕊试纸变蓝,A项错误;
B. 由上述分析可知,白色沉淀甲为氢氧化镁,属于纯净物,B项错误;
C. 无色溶液乙含有碳酸氢钠,无色溶液丙中含有氯化铝和HCl,二者反应可生成二氧化碳,也可能生成氢氧化铝沉淀(取决于盐酸量的多少),C项正确;
D. 通过以上分析知,固体粉末中一定含有MgCl2、Al与AlCl3中至少存在一种,可能含有(NH4)2SO4,一定不存在FeCl2,D项错误;
答案选C。


 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案科目:高中化学 来源: 题型:
【题目】已知299 K时,合成氨反应 N2(g ) + 3H2 ( g )![]() 2NH3( g ) △H = -92.0 kJ/mol,将此温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量为(忽略能量损失)
2NH3( g ) △H = -92.0 kJ/mol,将此温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量为(忽略能量损失)
A. 一定大于92.0 kJB. 一定等于92.0 kJ
C. 一定小于92.0 kJD. 不能确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“封管实验”具有简易、方便、节约、绿色等优点,下列关于三个“封管实验”(夹持装置未画出)的说法正确的是( )

A. 加热时,①中上部汇集了NH4Cl固体
B. 加热时,②中溶液变红,冷却后又都变为无色
C. 加热时,③中溶液红色褪去,冷却后溶液变红,体现SO2的漂白性
D. 三个“封管实验”中所发生的化学反应都是可逆反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.![]() 的一溴代物和
的一溴代物和 ![]() 的一溴代物都有4种(不考虑立体异构)
的一溴代物都有4种(不考虑立体异构)
B.CH3CH=CHCH3 分子中的四个碳原子在同一直线上
C.按系统命名法,化合物 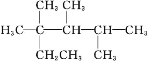 的名称是:2,3,4-三甲基-2-乙基戊烷
的名称是:2,3,4-三甲基-2-乙基戊烷
D.C6H14的同分异构体有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A. 1molCl2与足量Fe反应转移电子数一定为3NA
B. 标准状况下,2.24LNH3中含有共价键的数目为NA
C. 标况下,11.2LSO3所含的分子数目为0.5NA
D. lmolNa2O和Na2O2混合物中含有的阴、阳离子总数是3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)298K时,将20mL3xmol·L-1Na3AsO3、20mL3xmol·L-1I2和20mLNaOH溶液混合,发生反应:AsO![]() (aq)+I2(aq)+2OH-(aq)
(aq)+I2(aq)+2OH-(aq)![]() AsO
AsO![]() (aq)+2I-(aq)+H2O(l)。溶液中c(AsO
(aq)+2I-(aq)+H2O(l)。溶液中c(AsO![]() )与反应时间(t)的关系如图所示。
)与反应时间(t)的关系如图所示。
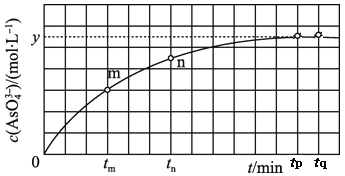
①下列可判断反应达到平衡的是__(填标号)。
a.溶液的pH不再变化
b.v(I-)=2v(AsO![]() )
)
c.![]() 不再变化
不再变化
d.c(I-)=ymol·L-1
e.![]() =
=![]() 不再变化
不再变化
②tn时,v正__v逆(填“大于”“小于”或“等于”)。
③tm时v逆__tn时v逆(填“大于”“小于”或“等于”),理由是__。
④比较产物AsO![]() 在tm~tnmin和tp~tqmin时平均反应速率的大小,前者__;(填大或小或相等)
在tm~tnmin和tp~tqmin时平均反应速率的大小,前者__;(填大或小或相等)
(2)合成氨工厂常通过测定反应前后混合气体的密度来确定氨的转化率。某工厂测得合成塔中N2、H2混合气体的密度为0.5536g/L(标准状况),从合成塔中出来的混合气体在相同条件下密度为0.693g/L(标准状况)。该合成氨厂N2的转化率___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组以苯甲酸(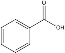 )为原料,制取苯甲酸甲酯,已知有关物质的沸点如表:
)为原料,制取苯甲酸甲酯,已知有关物质的沸点如表:
物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
沸点/℃ | 64.7 | 249 | 199.6 |
密度/g·cm-3 | 0.792 | 1.2659 | 1.0888 |
相对分子质量 | 32 | 122 | 136 |
Ⅰ.合成苯甲酸甲酯粗产品
在圆底烧瓶中加入12.2g苯甲酸和20mL甲醇(密度约为0.79g·cm-3),再小心加入3mL浓硫酸,混匀后,投入几块碎瓷片,小心加热使反应完全,得苯甲酸甲酯粗产品。
(1)浓硫酸的作用是______________;写出苯甲酸与甲醇反应的化学方程式:______________。
(2)甲和乙两位同学分别设计了如图所示的两套实验室合成苯甲酸甲酯的装置(夹持仪器和加热仪器均已略去)。根据有机物的沸点,最好采用__________装置(填“甲”或“乙”)

(3)反应物CH3OH应过量,理由是______________。
Ⅱ.粗产品的精制
(4)苯甲酸甲酯粗产品中往往含有少量甲醇、苯甲酸和水等,现拟用下列流程图进行精制,请在流程图中方括号内填入操作方法的名称a______________,b______________。
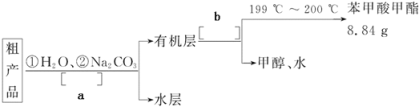
(5)通过计算,苯甲酸甲酯的产率为______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A,B,C,D四种物质之间的转化关系如图所示![]() 部分产物略去
部分产物略去![]() ,下列说法正确的是
,下列说法正确的是 ![]()
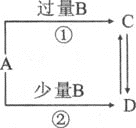
A.当A为铁单质时,C的溶液与KSCN溶液反应,生成红色沉淀
B.当B为![]() 时,A只能为
时,A只能为![]()
C.当A为![]() 时,反应
时,反应![]() 可能产生白烟
可能产生白烟
D.当A为![]() ,反应
,反应![]() 得到无色溶液
得到无色溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A+B→C △H <0,分两步进行 ① A+B→X △H>0 ② X→C △H<0 。下列示意图中,能正确表示总反应过程中能量变化的是
A.  B.
B. 
C.  D.
D. 
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com