
����Ŀ�����Ͳ���ң���M��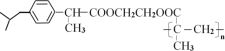 ���dz����ڽ�����ʹҩ�M��һ�ֺϳ�·����ͼ��
���dz����ڽ�����ʹҩ�M��һ�ֺϳ�·����ͼ��
��֪��RCOOR��+R��OH![]() RCOOR��+R��OH
RCOOR��+R��OH
�밴Ҫ��ش��������⣺
��Aϵͳ���������ƣ�__����Ӧ������Ϊ__��C���������ŵĽṹ��ʽ��__���Լ��ķ���ʽ��__��J��M��Ӧ���ͣ�__��
��A��ͬ���칹���ж��֣������ܷ���������Ӧ�Һ����ǻ�����_�֣�д�����к˴Ź���������3��壬�����֮��Ϊ6��1��1�Ľṹ��ʽ__��
��д��D+I��J��Ӧ�Ļ�ѧ����ʽ��__��
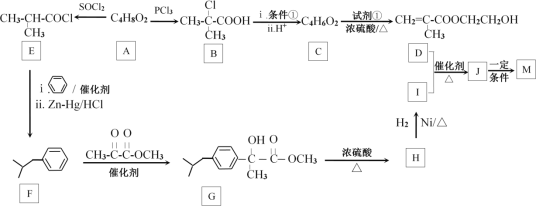
���Ա���![]() ����ͪ�������
����ͪ�������![]() ��Ϊ��ʼԭ���Ʊ��л���N��
��Ϊ��ʼԭ���Ʊ��л���N��![]() ����д��N�ĺϳ�·��___�������Լ���ѡ���ϳ�·��ʾ������ɣ��л����д�ṹ��ʽ����
����д��N�ĺϳ�·��___�������Լ���ѡ���ϳ�·��ʾ������ɣ��л����д�ṹ��ʽ����

���𰸡�2-������(�������) NaOH�Ҵ���Һ���� ![]() ����COOH C2H6O2 �Ӿ۷�Ӧ 5
����COOH C2H6O2 �Ӿ۷�Ӧ 5 ![]()
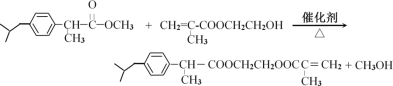
��������
����B�Ľṹ��A��B��ȡ����Ӧ�ó�A�Ľṹ��ʽΪ![]() �����ݺ�����Ϣ�õ�B������ȥ��Ӧ���ữ�õ�C(
�����ݺ�����Ϣ�õ�B������ȥ��Ӧ���ữ�õ�C(![]() )��A��E����ȡ����Ӧ����E(
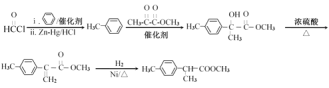
)��A��E����ȡ����Ӧ����E(![]() )��E�ͱ�����Zn-Hg/HCl���ڴ���������Ӧ����F��F��
)��E�ͱ�����Zn-Hg/HCl���ڴ���������Ӧ����F��F��![]() �����ӳɷ�Ӧ����
�����ӳɷ�Ӧ����![]() ��
��![]() ��Ũ���������·�����ȥ��Ӧ�õ�H��H�ڴ��������·����ӳɷ�Ӧ�õ�I(
��Ũ���������·�����ȥ��Ӧ�õ�H��H�ڴ��������·����ӳɷ�Ӧ�õ�I(![]() )��I��
)��I��![]() ����ȡ����Ӧ����J��J�����Ӿ۷�Ӧ�õ�M��
����ȡ����Ӧ����J��J�����Ӿ۷�Ӧ�õ�M��
��A(![]() )ϵͳ���������ƣ�2-������(�������)����Ӧ�������Ƿ�����ȥ��Ӧ����˷�Ӧ����ΪNaOH�Ҵ���Һ���ȣ�C����������Ϊ̼̼˫�����Ȼ���������ŵĽṹ��ʽ��
)ϵͳ���������ƣ�2-������(�������)����Ӧ�������Ƿ�����ȥ��Ӧ����˷�Ӧ����ΪNaOH�Ҵ���Һ���ȣ�C����������Ϊ̼̼˫�����Ȼ���������ŵĽṹ��ʽ��![]() ����COOH���Լ����Ҷ����������ʽ��C2H6O2������M�Ľṹ��ʽ��J��M��Ӧ���ͣ��Ӿ۷�Ӧ���ʴ�Ϊ��2-������(�������)��NaOH�Ҵ���Һ���ȣ�
����COOH���Լ����Ҷ����������ʽ��C2H6O2������M�Ľṹ��ʽ��J��M��Ӧ���ͣ��Ӿ۷�Ӧ���ʴ�Ϊ��2-������(�������)��NaOH�Ҵ���Һ���ȣ�![]() ����COOH��C2H6O2���Ӿ۷�Ӧ��
����COOH��C2H6O2���Ӿ۷�Ӧ��
��A��ͬ���칹���ж��֣������ܷ���������Ӧ�Һ����ǻ���˵�����С�CHO�͡�OH����������̼ԭ�ӣ�����ȡ��������ͬһ��̼ԭ���������֣��ڲ�̼ͬԭ���������ֽṹ������5�֣����к˴Ź���������3��壬�����֮��Ϊ6��1��1�Ľṹ��ʽ![]() ���ʴ�Ϊ��5��
���ʴ�Ϊ��5��![]() ��
��
��D+I��J��Ӧ��ȡ����Ӧ���仯ѧ����ʽ��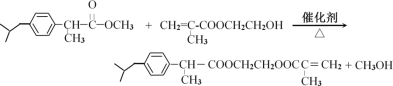 ���ʴ�Ϊ��
���ʴ�Ϊ��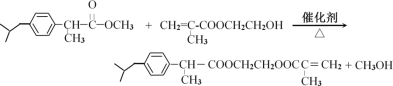 ��
��
��![]() �뱽������Zn-Hg/HCl����������Ӧ����
�뱽������Zn-Hg/HCl����������Ӧ����![]() ��
��![]() ��
��![]() �ڴ��������·�Ӧ����
�ڴ��������·�Ӧ����![]() ��
��![]() ��Ũ���������¼�������
��Ũ���������¼�������![]() ��
��![]() �����������ӳɷ�Ӧ����
�����������ӳɷ�Ӧ����![]() ����ϳ�·��Ϊ��
����ϳ�·��Ϊ�� ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����10�֣���1���ڴ���CuSO4��5H2O�����г���������Fe2+�����ᴿʱΪ�˳�ȥFe2+�������������������ʹFe2+����ΪFe3+���������ʿɲ��õ���________��
A. KMnO4B. H2O2C. Cl2ˮ D. HNO3
Ȼ���ټ����ʵ����ʵ�������ҺpH=4��ʹFe3+ת��ΪFe(OH)3�����Դﵽ��ȥFe3+������ʧCuSO4��Ŀ�ģ�������ҺpH��ѡ�������е�________��
A. NaOH B. NH3��H2O C. CuO D. Cu(OH)2
��2����ͬѧ���ɵ�������ҺpH=4�Ƿ��ܴﵽ��ȥFe3+������ʧCu2+��Ŀ�ģ���ͬѧ��Ϊ����ͨ������ȷ�����������й����ϵõ��������ݣ�������Fe(OH)3���ܶȻ�Ksp=8.0��10-38,Cu(OH)2���ܶȻ�Ksp=3.0��10-20��ͨ����Ϊ��������Һ�е�����Ũ��С��1��10-5mol��L-1ʱ����Ϊ������ȫ������Һ��CuSO4��Ũ��Ϊ3.0 mol��L-1����Cu(OH)2��ʼ����ʱ��Һ��pHΪ________��Fe3+��ȫ����ʱ��Һ��pHΪ________��ͨ������ȷ����������________����������������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йط�Ӧ���ʵ�˵����ȷ���ǣ� ��
A.��ͬ�����£���״��С��ͬ��Mg��Al �ֱ���ͬŨ�ȵ����ᷴӦ��������ͬ
B.ʹ�ú��ʵĴ������Լӿ췴Ӧ���ʣ���������߷�Ӧ���ת����
C.���ݻ��̶��ĺ����ܱ������У������ϳ�NH3�ķ�Ӧ������He����Ӧ��������
D.10mL0.5mol��L��1��FeCl3��Һ����10mL��0.5mol��L��1��KSCN ��Һ����ַ�Ӧ�����KCl���壬��Һ��ɫ��dz
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͭ�Ļ������ڹ�ũҵ�����о�����Ҫ��λ���밴Ҫ��ش��������⡣
��.����Cu2O���ھ��������Ĵ����ܶ��ܵ���ע���±�Ϊ��ȡCu2O�����ַ�����
����a | �������ǻ�ԭ���Ƶ�Cu(OH)2(NaOH����)�Ʊ�Cu2O |
����b | ����(N2H4)���Ȼ�ԭ���Ƶ�Cu(OH)2�Ʊ�Cu2O��ͬʱ�ų�N2 |
����c | ��̿����1000�����ϻ�ԭCuO�Ʊ�Cu2O��ͬʱ�ų�CO |
(1)д������a�Ļ�ѧ����ʽ��__��
(2)��֪����2Cu(s)+![]() O2(g)=Cu2O(s) ��H=-169kJ��mol��1
O2(g)=Cu2O(s) ��H=-169kJ��mol��1
��C(s)+![]() O2(g)=CO(g) ��H=-110.5kJ��mol��1
O2(g)=CO(g) ��H=-110.5kJ��mol��1
��CuO(s)=Cu(s)+![]() O2(g) ��H=+157kJ��mol��1
O2(g) ��H=+157kJ��mol��1
д������c��Ӧ���Ȼ�ѧ����ʽ��__��
(3)����ͬ���ܱ������У����ϱ������Ƶõ�����Cu2O�ֱ���д��ֽ�ˮ��ʵ�飺2H2O(g)![]() 2H2(g)+O2(g) ��H��0��ˮ������Ũ����ʱ��t�仯���±���ʾ��
2H2(g)+O2(g) ��H��0��ˮ������Ũ����ʱ��t�仯���±���ʾ��
��� | 0 | 10 | 20 | 30 | 40 | 50 | |
i | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 | ii | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
iii | T2 | 0.100 | 0.0960 | 0.0930 | 0.0900 | 0.0900 | 0.0900 |
�Ա�����ʵ�����ݣ��ɻ�õĽ��ۣ�
�ٴ����Ĵ�Ч�ʣ�ʵ��i___ʵ��ii(����>����<����=������ͬ)��
��T1__T2��
��.��2L�ĺ����ܱ�������ͨ��5molO2����������Cu2S������Ӧ��Cu2S(s)+O2(g)=2Cu(s)+SO2(g) ��H1=-271.4kJ/mol��
��Ӧ������ij��������������ʱ��仯��ͼ��ʾ��
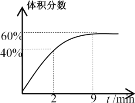
(4)��Ӧǰ2minƽ����Ӧ����v(SO2)=__�����¶��·�Ӧ��ƽ�ⳣ��K=__��
�������¶Ȳ�����ƽ����ϵ����ͨ��1molO2���ﵽ��ƽ����������������__(������������С��������������)ԭƽ��ʱ���������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ni�����仯�����ڹ�ҵ�����о�����Ҫ��λ����ͼ�ǹ�ҵ�������Ļ�������ʾ��ͼ��
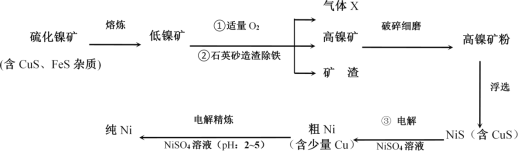
�밴Ҫ��ش��������⣺
��1��д������ͼ���������X��Ԫ���е縺�Խϴ����__����Ԫ�ط��ţ�������X������ԭ�ӵ��ӻ��������Ϊ___���÷��ӵ����幹�ͣ����ռ�ṹ��Ϊ__��
��2��Ni2����������Ų�ʽΪ__��
��3������Ni�в���һ������Alԭ�ӣ���ı侧��Ni�ģ�дһ���������ʣ�_��ij����������ɻ�������ҶƬ�����Ͻ�ľ����ṹ��ͼ��ʾ���úϽ�Ļ�ѧʽΪ_��
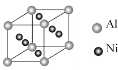
��4����֪���������ܶȻ�������Ksp(NiS)=1.07��10-21��Ksp(CuS)=1.27��10-36
��ҵ�����г��ü�NiS�ķ�����ȥ��Һ�е�Cu2+�������˺���Һ��c(Ni2+)Ϊ0.107mol��L-1������Һ�в�����c(Cu2+)Ϊ_��д������ͼ�Т�NiS����������ŵ�ĵ缫��ӦʽΪ__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ�о�Ũ�ȶԻ�ѧƽ���Ӱ�죬����˵����ȷ����
��֪��Cr2O72-(aq)(��ɫ)+H2O(l) | |
���裺 �������� | ���� ���Թ�b����ɫ��������Թ�a�Ƚϣ� ��Һ��ɫ��dz�� �μ�Ũ���ᣬ�Թ�c�¶��������ߣ� ��Һ��ɫ���Թ�a��ȣ���� |
A. �÷�Ӧ��һ��������ԭ��Ӧ
B. ���Թ�b����Һ��ɫ�����Ŀ����ʹCr2O72-��ȫ��Ӧ
C. ��ʵ�鲻��֤����С������Ũ�ȣ�ƽ�������ƶ�
D. �Թ�c�е�����˵��Ӱ��ƽ�����Ҫ�������¶�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ�ǿ����ۺ����õġ��Ӻ�ˮ����ȡʳ�κ���Ĺ������£�
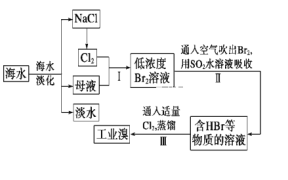
��1����д��һ�ֺ�ˮ�����ķ�����__��
��2��������ȡBr2�����ӷ���ʽΪ___��
��3���������SO2ˮ��Һ����Br2��ʹ������ת��Ϊ�������Դﵽ������Ŀ�ġ��䷴Ӧ�Ļ�ѧ����ʽΪBr2��SO2��2H2O=H2SO4��2HBr���ڸ÷�Ӧ�У���������__(�ѧʽ)������Ӧ������2molHBr��������___molSO2��
��4������������Ӧ�ж�SO2��Cl2��Br2����������������ǿ������˳����__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����H2(g)��![]() O2(g)=H2O(g) ��H1��akJ��mol1
O2(g)=H2O(g) ��H1��akJ��mol1
��2H2(g)��O2(g)=2H2O(g) ��H2��bkJ��mol1
��H2(g)��![]() O2(g)=H2O(l) ��H3��ckJ��mol1
O2(g)=H2O(l) ��H3��ckJ��mol1
��2H2(g)��O2(g)=2H2O(l) ��H4��d kJ��mol1
���й�ϵʽ����ȷ����
A.a<c<0B.b>d>0C.2a��b<0D.2c��d>0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͨ�����ǰѲ�1mol ij��ѧ�������յ��������ɸû�ѧ���ļ��ܡ����ܵĴ�С�����ڹ��㻯ѧ��Ӧ�ķ�Ӧ��(��H)��
��ѧ�� | Cl��Cl | H��H | H��Cl | N��N |
����/kJ��mol | 243 | 436 | 431 | 946 |
(1)��Ҫ��������
a.2HCl(g) �� H2(g)��Cl2(g)����H=______________________
b.N2 (g)+3H2(g)= 2NH3(g) ��H=-92kJ/mol����N��H���ļ�����__________kJ��mol
(2)1 mol NO2��1mol CO��Ӧ����CO2��NO�����������仯ʾ��ͼ����д��NO2��CO��Ӧ���Ȼ�ѧ����ʽ__________________________________

(3) ��֪�ڳ��³�ѹ�£�
�� 2CH3OH(l) �� 3O2(g) �� 2CO2(g) �� 4H2O(g) ��H1
�� 2CO (g)+ O2(g) �� 2CO2(g) ��H2
�� H2O(g) �� H2O(l) ��H3
��CH3OH(l)��O2(g)=CO(g)+ 2H2O(l)��H =__________(�ú���H1����H2����H3��ʽ�ӱ�ʾ)
(4)��֪��2Al (s)+ 3/2O2(g)==Al2O3(s) ��H=-1644.3 kJ mol-1
2Fe (s) +3/2O2(g)==Fe2O3(s) ��H=-815.88kJ mol-1
��д����������������ĩ�������ȷ�Ӧ���Ȼ�ѧ����ʽ_______________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com