
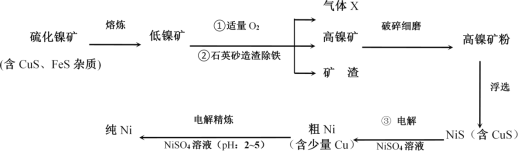
【题目】镍(Ni)及其化合物在工业生产中具有重要地位。如图是工业精制镍的基本流程示意图:
请按要求回答下列问题:
(1)写出流程图中组成气体X的元素中电负性较大的是__(填元素符号)。气体X的中心原子的杂化轨道类型为___,该分子的立体构型(即空间结构)为__。
(2)Ni2+核外电子排布式为__。
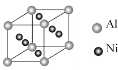
(3)向晶体Ni中掺入一定量的Al原子,会改变晶体Ni的(写一种物理性质)_。某种用于铸造飞机发动机叶片镍铝合金的晶胞结构如图所示,该合金的化学式为_。
(4)已知:常温下溶度积常数:Ksp(NiS)=1.07×10-21;Ksp(CuS)=1.27×10-36
工业生产中常用加NiS的方法除去溶液中的Cu2+,若过滤后溶液中c(Ni2+)为0.107mol·L-1,则滤液中残留的c(Cu2+)为_。写出流程图中③NiS在阳极参与放电的电极反应式为__。
【答案】O sp2杂化 V形 [Ar]3d8(或1s22s22p63s23p63d8) 延展性(或硬度、密度、熔点、沸点等) Ni3Al(或AlNi3) 1.27×10-16mol·L-1 NiS2e-=Ni2++S
【解析】
硫化镍矿经熔炼得到低镍矿,通入氧气,产生的气体为SO2,高镍矿经研磨浮选得到NiS,NiS在第三步电解时在阳极失电子,得到S单质。
(1)根据流程图,可知X是SO2,电负性较大的是O,中心原子的杂化轨道类型为sp2杂化,该分子的立体构型(即空间结构)为V形,故本题答案为:O;sp2杂化;V形;
(2)Ni是28号元素,根据电子排布规律,Ni2+核外电子排布式为[Ar]3d8(或1s22s22p63s23p63d8);
(3)向晶体Ni中掺入一定量的Al原子,改变了晶体结构,改变了晶体的延展性(或硬度、密度、熔点、沸点等)等。根据镍铝晶胞结构,Al的个数为![]() ,Ni的个数为
,Ni的个数为![]() ,该合金的化学式为Ni3Al,故本题答案为:延展性(或硬度、密度、熔点、沸点等);Ni3Al;
,该合金的化学式为Ni3Al,故本题答案为:延展性(或硬度、密度、熔点、沸点等);Ni3Al;
(4)过滤后溶液中c(Ni2+)为0.107mol·L-1,则c(S2-)= Ksp(NiS)/ c(Ni2+)=1.07×10-21/0.107=10-20mol·L-1,c(Cu2+)= Ksp(CuS)/c(S2-)=1.27×10-36/10-20mol·L-1=1.27×10-16mol·L-1,图③中NiS在阳极失电子,发生的电极反应为NiS2e-=Ni2++S,故本题答案为:1.27×10-16mol·L-1;NiS2e-=Ni2++S。


 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
【题目】如图在化学实验中有多种用途:

(1)现用此装置收集氨气,气体从_____口通入,若用此装置收集氯气,气体从____口通入。
(2)现有位同学采用排水法收集氨气,其装置如图:

气体从_______口通入,上层液体应选择_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有MgO、Al2O3、SiO2、Fe2O3组成的混合粉末。现取两份该混合粉末试样进行实验。
(1)将一份混合粉末溶于过量的盐酸,得到沉淀X和滤液Y
①沉淀X为_______(填化学式,下同), 滤液Y中含有的阳离子主要是_______。
②向滤液Y中加入过量氢氧化钠溶液,得到的沉淀是___________。
(2)将另一份混合粉末溶于过量氢氧化钠溶液,发生反应的离子方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,钠与O2反应可生成1.5 g固体,若将相同质量的钠与80 mL 0.50 mol·L-1的盐酸反应,钠恰好完全转化为NaCl,则1.5 g固体的成分可能是( )
A.Na2OB.Na2O2C.Na2O和Na2O2D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铋酸钠(NaBiO3)广泛应用于制药业。其粉末呈浅黄色,不溶于冷水,遇沸水或酸则迅速分解。某同学设计如下实验,利用白色且难溶于水的Bi(OH)3在NaOH溶液中与Cl2反应制备NaBiO3,并探究其应用与纯度测定。请按要求回答下列问题:
(1)已知:Bi是N同主族元素,周期序数相差4,则Bi的原子序数为__。
Ⅰ.NaBiO3的制备,实验装置如图(加热和夹持仪器已略去)
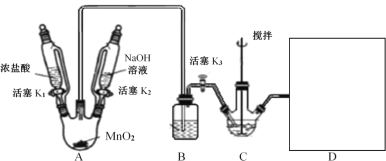
(2)A装置制备的气体是__;B装置的作用是__;补全图中D装置图(并标注试剂名称)___。
(3)C中反应的离子方程式为__。当观察到现象为___时,可以初步判断C中反应已经完成。
(4)反应完成后,处理装置A烧瓶中残留气体需进行的操作:__;为从装置C中获得尽可能多的产品,需进行的操作:__、过滤、洗涤、干燥。
Ⅱ.铋酸钠的应用,检测Mn2+
(5)向含有Mn2+的溶液中加入铋酸钠,再加入硫酸酸化,溶液变为紫红色,此反应中铋酸钠的作用是__;同学甲再向其中滴加MnSO4浓溶液,振荡,观察到紫红色褪去,有黑色固体(MnO2)生成,产生此现象的离子反应方程式为__。
Ⅲ.产品纯度的测定
(6)取上述NaBiO3(Mr=280)产品ag,加入适量稀硫酸和MnSO4稀溶液使其完全转化为Bi3+,再用bmo1·L-1的H2C2O4标准溶液滴定,当溶液紫红色恰好褪去时(假设Mn元素完全转化为Mn2+),消耗VmL标准溶液。该产品的纯度为__(用含a、b、V的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
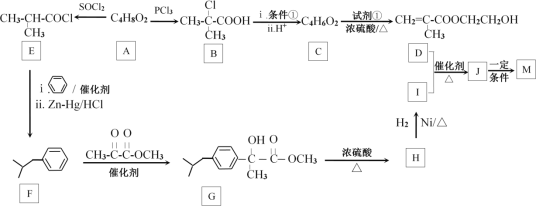
【题目】缓释布洛芬(即M: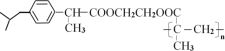 )是常用于解热镇痛药物。M的一种合成路线如图:
)是常用于解热镇痛药物。M的一种合成路线如图:
已知:RCOOR′+R″OH![]() RCOOR″+R′OH
RCOOR″+R′OH
请按要求回答下列问题:
⑴A系统命名的名称:__;反应条件①为__;C所含官能团的结构简式:__;试剂的分子式:__;J→M反应类型:__。
⑵A的同分异构体有多种,其中能发生银镜反应且含有羟基的有_种;写出其中核磁共振氢谱有3组峰,峰面积之比为6:1:1的结构简式__。
⑶写出D+I→J反应的化学方程式:__。
⑷以苯、![]() 、丙酮酸甲酯(
、丙酮酸甲酯(![]() )为起始原料制备有机物N(
)为起始原料制备有机物N(![]() ),写出N的合成路线___(其他试剂任选,合成路线示例见题干,有机物均写结构简式)。
),写出N的合成路线___(其他试剂任选,合成路线示例见题干,有机物均写结构简式)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行反应CH4(g)+H2O(g) ![]() CO(g)+3H2(g) △H>0,测得c(CH4)随反应时间(t)的变化如图所示。下列判断正确的是( )
CO(g)+3H2(g) △H>0,测得c(CH4)随反应时间(t)的变化如图所示。下列判断正确的是( )
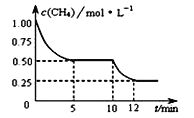
A. 10 min时,改变的外界条件可能是升高温度
B. 反应进行到12min时,CH4的转化率为25%
C. 0∽5 min内,v(H2)=0.1 mol·(L·min)-1
D. 恒温下,缩小容器体积,平衡后H2浓度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2(g)+Cl2(g)=2HCl(g) ΔH= -184.6kJ/mol,则![]() H2(g)+
H2(g)+![]() Cl2(g)=HCl(g)的ΔH为( )
Cl2(g)=HCl(g)的ΔH为( )
A.+184.6kJ/molB.-92.3kJ/molC.-369.2kJ/molD.+92.3kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对污水处理的化学方法及其原理的描述错误的是( )
A. 明矾放入污水中就会发生反应: Al3++3H2O![]() Al(OH)3(胶体)+3H+
Al(OH)3(胶体)+3H+
B. 用氢氧化钙来中和钢铁厂、电镀厂产生的酸性废水,用硫酸或CO2中和碱性废水
C. 利用沉淀反应是除去水中重金属离子常用的方法
D. 处理含有重金属离子的废水一定不涉及氧化还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com