
某化学小组在学习元素周期律后,对教材中Fe2+氧化为Fe3+的实验进一步思考,并提出问题:Cl2能将Fe2+氧化为Fe3+,那么Br2和I2能否将Fe2+氧化为Fe3+?
环节一:理论推测
部分同学认为Br2和I2都可能将Fe2+氧化为Fe3+,他们思考的依据是 。
部分同学认为Br2和I2都不能将Fe2+氧化为Fe3+,还有同学认为Br2能将Fe2+氧化为Fe3+而I2不能。他们思考的依据是从上到下卤素单质氧化性减弱。
环节二:设计实验进行验证
在大试管中加适量铁粉,加入10 mL 稀盐酸,振荡试管,充分反应后,铁粉有剩余,取上层清液进行下列实验。
实验1:
| 试管 | 操作 | 现象 |
| ① | 先向试管中加入2 mL FeCl2溶液,再滴加少量红棕色的溴水,振荡试管 | 溶液为黄色 |
| ② | 先向试管中加入2 mL FeCl2溶液,再滴加少量棕黄色的碘水,振荡试管 | 溶液为黄色 |
| 操作 | 应该观察到的现象 |
| | |
| 操作 | 现象 |
| 向试管②所得溶液中继续加入0.5 mLCCl4,充分振荡,静置一段时间后。取出上层溶液,滴加KSCN 溶液 | 静置后,上层溶液几乎无色,下层溶液为紫色;上层溶液滴加KSCN 溶液后,出现浅红色 |
| 操作 | 现象 |
| 向另一支试管中加入2 mL FeCl2溶液,滴加0.5mL碘水后,再加入0.5mL 乙酸乙酯,充分振荡,静置一段时间后。取出下层溶液,滴加KSCN 溶液 | 静置后,上层液为紫色,下层液几乎无色;下层溶液滴加KSCN溶液后,没有出现浅红色 |
(12分)
环节一:均为第七主族单质,氧化性均较强 (2分)(表述合理给分)
环节三:
(1) 2Fe2++Br2=2Fe3++2Br- (2分)操作 应该观察到的现象 取少量①的黄色溶液于试管中,滴加少量KSCN溶液,振荡,
(1分)溶液变为红色
(1分)
(2)可能2:碘水与FeCl2溶液发生反应,但FeCl3溶液也是黄色的,所以没有明显现象。
(2分)(表述合理给分)
亚铁离子与空气接触会被氧化,加入乙酸乙酯既可作为萃取剂又能起到液封的作用,减少空气对实验的影响。(2分)(表述合理给分)
(3)同一主族元素从上到下原子核外电子层数依次增多,原子半径逐渐增大,得电子能力逐渐减弱,氧化性减弱。(2分)(表述合理给分)
解析试题分析:环节一:根据元素周期律,以Cl2为类比对象,叙述合理即可,故答案:均为第七主族单质,氧化性均较强 (2分)(表述合理给分)
环节三:
类比Cl2,Br2作氧化剂,发生的反应 2Fe2++Br2=2Fe3++2Br- ,故答案:2Fe2++Br2=2Fe3++2Br- (2分)
实验一中无法确定是否含有Fe3+ ,需用SCN―溶液检验,故答案:操作 应该观察到的现象 取少量①的黄色溶液于试管中,滴加少量KSCN溶液,振荡,
(1分)溶液变为红色
(1分)
(2)可能2:碘水和Fe3+ 溶液都是黄色,所以可能是碘水与FeCl2溶液发生反应,但现象不明显,答案:碘水与FeCl2溶液发生反应,但FeCl3溶液也是黄色的,所以没有明显现象。(2分)(表述合理给分)
Fe2+ 具有较强的还原性,在实验中要消除空气中氧气对实验带来的影响,所用的萃取剂密度比水小更合理,既作萃取剂,又起液封的作用,故答案:亚铁离子与空气接触会被氧化,加入乙酸乙酯既可作为萃取剂又能起到液封的作用,减少空气对实验的影响。(2分)(表述合理给分)
(3)结构决定性质,同一主族元素从上到下原子核外电子层数依次增多,是Cl2、Br2、I2氧化性逐渐减弱的根本原因,故答案:同一主族元素从上到下原子核外电子层数依次增多,原子半径逐渐增大,得电子能力逐渐减弱,氧化性减弱。(2分)(表述合理给分)
考点:实验探究、元素及其化合物、元素周期律


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案科目:高中化学 来源: 题型:填空题
高锰酸钾和二氧化锰是中学化学常用的化学试剂。根据下面相关的信息回答下列问题:
(1)已知: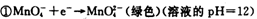
②
锰有多种化合价,如+7、十6、+4、+2价等,在中性溶液里高锰酸钾的还原产物为 (填化学式)。
(2)查阅相关资料:发生如下反应(反应未配平):
已知在高锰酸钾固体表面滴加浓盐酸,发生的半反应为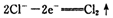
如果在盛有氯化锰溶液的试管中加入适量XeO3,振荡试管,可能观察到的现象是 。
(3)已知草酸(H2C2O4)为二元弱酸,取少量草酸晶体溶于酸性高锰酸钾溶液,溶液的紫色褪去。
写出该反应的离子方程式 。
(4)MnO2是一种重要的无机功能材料,制备MnO2的方法之一是以石墨为电极,电解酸化的MnSO4溶液,阳极的电极反应式为 。现以铅蓄电池为电源电解酸化的MnSO4溶液,如图所示,铅蓄电池的总反应方程式为 ,当蓄电池中有4mol H+被消耗时,则电路中通过的电子的物质的量为 ,MnO2的理论产量为 g。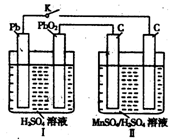
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
为验证氧化性Cl2>Fe3+>SO2,某小组用下图所示装置进行实验(夹持仪器和甲中加热装置已略,气密性已检验)。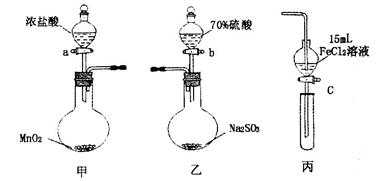
实验步骤:
1.在甲装置中,打开活塞a,加热,待装置中充满黄绿色气体时,与丙装置连接。
2.当丙装置中FeC12溶液变黄时,停止加热。
3.打开活塞c,使约2mL的溶液滴入试管中,检验溶液中的离子。
4.在乙装置中,打开活塞b,待空气排尽后,将乙中产生的气体通入上述丙装置变黄后的溶液中,一段时间后,停止。
5.更新丙中试管,打开活塞c,使约2mL的溶液滴入试管中,检验溶液中的离子。
回答下列问题:
(1)甲中发生反应的化学方程式为______________________。
(2)用70%的硫酸制取SO2,反应速率比用98%的硫酸快,原因是____________。
(3)实验中,证明氧化性Fe3+>SO2的离子方程式为_____________。
(4)有I、II、III三组同学分别完成了上述实验,实验结果如下:
| | 步骤3溶液中含有的离子 | 步骤5溶液中含有的离子 |
| I | 既有Fe3+又有Fe2+ | 有SO42- |
| Ⅱ | 有Fe3+无Fe2+ | 有SO42- |
| Ⅲ | 有Fe3+无Fe2+ | 有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
Na2SO3在空气中易被氧化而变质。某同学为证明Na2SO3有还原性,从一瓶实验室长期存放的Na2SO3固体中取出少量溶于水,滴入一定量的烧碱溶液和少许溴水,振荡后溶液变为无色。
(1)在碱性溶液中Br2和Na2SO3反应的离子方程式 。
(2)反应后的溶液含有SO32-、SO42-、Br-、OH-等阴离子,下表是某同学鉴定其中SO32-、SO42-和Br-的实验报告,请完成未填完的部分。
限选试剂:2 mol·L-1HCl;1 mol·L-1 H2SO4;l mol·L-1BaCl2;l mol·L-1Ba(NO3)2;1 mol·L-1 KMnO4、CCl4;新制饱和氯水;品红溶液。
| 编号 | 实验操作 | 预期现象和结论 |
| 步骤① | 取少量待测液加入试管中,加入过量2mol·L-1HCl,再滴加适量1 mol·L-1BaCl2 溶液。 | 有白色沉淀生成,证明待测液中含有、SO42- 。 |
| 步骤② | | |
| 步骤③ | | |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
二氧化氮(NO2)是一种具有高度活性的气态物质,NO2与Na2O2均具有较强的氧化性,某研究性学习小组对二者能否发生反应进行探究。
【实验】
下列关于实验室制备NO2的说法正确的是_______
a.实验室常用铜和浓硝酸反应制取二氧化氮
b.二氧化氮常用向下排空气法收集
c.二氧化氮易溶于水,尾气可用水吸收.
d.用注射器收集的二氧化氮,压缩后颜色变浅
e.实验后容器中残留液需用碱液处理
【提出假设】
假设一:NO2与Na2O2二者不反应;
假设二:NO2能被Na2O2氧化;
假设三:
【查阅文献】
NO2在反应中能生成HNO3和HNO2;HNO2旣有氧化性,又有还原性,能被强氧化剂如KMnO4氧化。
【设计实验】
(1)实验时,将NO2气体通入盛有Na2O2的玻璃管中,淡黄色粉末完全变成白色,说明假设 不成立。
(2)若假设二成立,反应的化学方程式是 。
(3)为验证假设二是否成立,该小组同学做了如下定性实验研究,请完成下表内容。
| 实验步骤 (不要求写具体操作过程,仪器任选) | 预期的实验现象及结论 |
| 取适量的白色固体置于试管中,………… | |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
观察是研究物质性质的一种基本方法.一同学将一小块金属钠露置于空气中,观察到下列现象:银白色→①变灰暗→②变白色→③出现液滴→④白色固体,下列说法中正确的是 ( )
| A.①发生了氧化还原反应 | B.②变白色是因为生成了碳酸钠 |
| C.③是碳酸钠吸收空气中的水蒸气形成了溶液 | D.④只发生物理变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
把一块镁铝合金投入到1 mol/L酸中,待合金完全溶解后,再往溶液里加入1 mol/L NaOH溶液,生成沉淀的物质的量随加入NaOH溶液的体积变化的关系如下图所示,下列说法中错误的是( )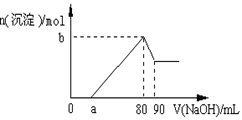
| A.盐酸的体积为80ml | B.a的取值范围为0≤ a <50 |
| C.n(Mg2+)<0.025mol | D.当a值为30时,b值为0.01 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知HCO3―+AlO2― +H2O=CO32― +Al(OH)3↓;将足量的KHCO3溶液不断滴入含等物质的量的KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀的物质的量与滴入的KHCO3溶液体积的关系可表示为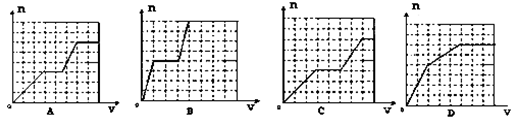
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com