
【题目】下列事实中,能说明氯的非金属性比硫强的是( )
A.次氯酸(HClO)的酸性比硫酸强
B.次氯酸的氧化性比稀硫酸强
C.氯化氢比硫化氢的热稳定性好
D.最外层电子数氯原子的比硫原子的多
 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:
【题目】苯达莫司汀(Bendamustine)是一种抗癌药物。苯达莫司汀的一种合成路线如下:


(1) D中含氧官能团有酰胺键、____(填名称)。
(2) A→B的反应类型为____。
(3) E的分子式为C12H13N3O4,写出E的结构简式:__________。
(4) G是 的同分异构体,G能发生银镜反应,分子中只有2种不同化学环境的氢。写出一种符合条件的G的结构简式:__________。
的同分异构体,G能发生银镜反应,分子中只有2种不同化学环境的氢。写出一种符合条件的G的结构简式:__________。
(5)已知: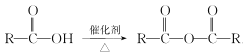 。请写出以
。请写出以![]() 乙醇为原料制备
乙醇为原料制备 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)__________________________。
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“温室效应”是全球关注的环境问题之一。CO2是目前大气中含量最高的一种温室气体,CO2的综合利用是解决温室及能源问题的有效途径。
(1)CO2催化加氢能合成低碳烯烃:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g)。不同温度下平衡时的四种气态物质的物质的量如图所示,则曲线b表示的物质为________(填化学式)。
C2H4(g)+4H2O(g)。不同温度下平衡时的四种气态物质的物质的量如图所示,则曲线b表示的物质为________(填化学式)。

(2)CO2和H2在催化剂Cu/ZnO作用下可发生两个平行反应,分别生成CH3OH和CO。
反应A:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
反应B:CO2(g)+H2(g)![]() CO(g)+H2O(g)
CO(g)+H2O(g)
控制CO2和H2初始投料比为1∶3时,温度对CO2平衡转化率及甲醇和CO产率的影响如图所示。

①由图可知温度升高CO的产率上升,其主要原因可能是_____。
②由图可知获取CH3OH最适宜的温度是________,下列措施有利于提高CO2转化为CH3OH的平衡转化率的有________(填字母)。
A. 使用催化剂
B. 增大体系压强
C. 增大CO2和H2的初始投料比
D. 投料比和容器体积不变,增加反应物的浓度
(3)在恒温恒容条件下,反应A达到平衡的标志有_____
A. 容器中气体压强不再发生变化
B. 容器中气体密度不再发生变化
C. 容器中气体颜色不再发生变化
D. 容器中气体平均摩尔质量不再发生变化
(4)由CO2制取C的太阳能工艺如图所示。“热分解系统”发生的反应为2Fe3O4![]() 6FeO+O2↑,每分解1 mol Fe3O4转移电子的物质的量为_____;“重整系统”发生反应的化学方程式为___。
6FeO+O2↑,每分解1 mol Fe3O4转移电子的物质的量为_____;“重整系统”发生反应的化学方程式为___。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述错误的是( )
A.合金材料中可以含有非金属元素
B.三大合成材料是指人造纤维、塑料和橡胶
C.加热能杀死非典冠状病毒,是因为病毒中的蛋白质受热变性
D.在汽车排气管上加装“催化转化器”是为了减少有害气体的排放
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】小王同学准备用CuSO4·5H2O配制500mL0.1mol·L-1CuSO4溶液。
(1)小王同学选用的容量瓶规格为_______mL。
(2)玻璃棒在该实验中有重要的用途,分别是________ 和__________。
(3)小王同学通过计算,用托盘天平称取_________ gCuSO4·5H2O。
(4)有关物质的量浓度的误差分析(填“偏高”、“偏低”或“无影响”):①若容量瓶洗净未为干燥,残留少量水分,则所配制溶液的浓度将__________。②定容时,若俯视刻度线,则所配制的溶液浓度将__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)为了求某NaHCO3、Na2CO3混合物中NaHCO3的质量分数,现将m1g样品加热至质量恒定时停止加热,此时质量为m2g,已知加热时发生的反应式是2NaHCO3![]() Na2CO3+CO2↑+H2O,则NaHCO3的质量分数是_________。
Na2CO3+CO2↑+H2O,则NaHCO3的质量分数是_________。
(2)臭氧层是地球生命的保护神,臭氧比氧气具有更强的氧化性。实验室可将氧气通过高压放电来制取臭氧:3O2![]() 2O3。将8L氧气通过放电管后,恢复到原状况,得到气体是6.5L,其中臭氧是_____ L。
2O3。将8L氧气通过放电管后,恢复到原状况,得到气体是6.5L,其中臭氧是_____ L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸盐是优良的多功能水处理剂。某实验小组釆用如图装置制备高铁酸钾(K2FeO4)并探究其性质用途。

Ⅰ.制备K2FeO4(夹持、加热等装置略)

(1)B中所用试剂为______________________。
(2)C中反应为放热反应,而反应温度须控制在0~8℃,可使用的控温方法为___________,充分反应后得到紫色固体,反应方程式为___________。反应中KOH必须过量的原因是___________。
(3)C中混合物经过滤、洗涤、干燥,得纯浄髙铁酸钾晶体,洗涤时洗涤剂可选用___________。
a.冰水 b.KOH溶液 c.异丙醇
Ⅱ.探究K2FeO4的性质
(4)K2FeO4可以将废水中的CN-氧化为CNO-,实验表明,pH=9时CN-去除效果最佳。配平反应离子方程式:____FeO42-+____CN-+____H2O→____Fe(OH)3↓+____CNO-+___OH-。
现处理含CN-离子浓度为13mg/L的废水1m3,至少需要K2FeO4___________g。
(5)资料表明,酸性溶液中氧化性FeO42->MnO4-。验证实验:将少K2FeO4溶解在过量KOH溶液中,溶液呈浅紫色,取该溶液滴入MnSO4和H2SO4的混合溶液中,振荡,溶液颜色仍然呈浅紫色。请设计实验证明最后所得浅紫色溶液中含有MnO4-___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:

(1)该浓盐酸中HCl的物质的量浓度为_____ mol/L。
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是___。
A.溶液中HCl的物质的量 B.溶液的浓度 C.溶液中Cl-的数目 D.溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制500 mL物质的量浓度为0.400 mol/L的稀盐酸。该学生需要量取___mL上述浓盐酸进行配制。
(4)①假设该同学成功配制 了0.400 mol/L的盐酸,他又用该盐酸中和含0.4 g NaOH的NaOH溶液,则该同学需取____ mL盐酸。
②假设该同学用新配制的盐酸中和含0.4 g NaOH的NaOH溶液,发现比①中所求体积偏小,则可能的原因是_____。
A.浓盐酸挥发,浓度不足 B.配制溶液时,未洗涤烧杯
C.配制溶液时,俯视容量瓶刻度线 D.加水时超过刻度线,用胶头滴管吸出
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com