
某消毒液的主要成分为 NaClO(混有少量NaCl),请用相应的化学用语来解释下列事实。
(1)该消毒液可用NaOH 溶液吸收Cl2 制备,化学方程式为_______________________。
(2)该消毒液的pH 约为12,离子方程式为__________________________。
(3)向FeSO4 溶液中滴入少量该溶液,溶液颜色变成棕黄色,反应的离子方程式为______________。
(4)该消毒液不能与洁厕灵(主要成分为浓盐酸)混用,否则会产生中毒危险。每产生1 mol Cl2(标准状况下),转移电子个数约为________________ 。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2015-2016学年山西省高二上学期第一次月考化学试卷(解析版) 题型:选择题
下列说法正确的是
A.可逆反应不可以自发进行
B.催化剂可以加块反应速率,也可增大反应物的转化率
C.当有多个反应参加时,使用催化剂,可增加目标产物的产率
D.H2与O2点燃生成H2O,H2O电解产生H2与O2,说明该反应可逆
查看答案和解析>>
科目:高中化学 来源:2016届吉林省高三上学期二次模拟测试理综化学试卷(解析版) 题型:填空题
【化学一一选修5:有机化学基础】(15分)
某药物可通过以下方法合成:

注:非诺洛芬是一种治疗类风湿性关节炎的药物。请回答下列问题:
(1)非诺洛芬中的含氧官能团为 和 (填名称)。
(2)反应①中加入的试剂X的分子式为C8H8O2,X的结构简式为 。
(3)在上述五步反应中,属于取代反应的是 (填序号)。
(4)B的一种同分异构体满足下列条件:
Ⅰ.能发生银镜反应,其水解产物之一能与FeCl3溶液发生显色反应。
Ⅱ.分子中有6种不同化学环境的氢,且分子中含有两个苯环。
写出该同分异构体的结构简式: 。
(5)根据已有知识并结合相关信息,写出以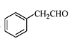 为原料制备
为原料制备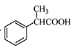 的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:

查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省高二上学期第一次月考化学试卷(解析版) 题型:填空题
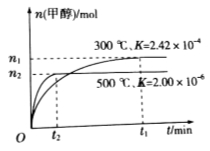
(8分)能源问题是人类社会面临的重大课题,甲醇是一种可再生能源,具有开发和应用的广阔前景,研究甲醇具有重要意义。
(1)用CO合成甲醇的反应为 。


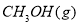 ;在容积为1L的密闭容器中分别充入1mol CO和2mol H2,实验测得甲醇的物质的量和温度、时间的关系曲线如图所示。则该正反应的
;在容积为1L的密闭容器中分别充入1mol CO和2mol H2,实验测得甲醇的物质的量和温度、时间的关系曲线如图所示。则该正反应的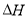 (填“<”“>”或“=”)0。
(填“<”“>”或“=”)0。
(2)利用工业废水中的CO2可制取甲醇,其反应为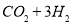

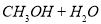 。
。
①已知下列反应的能量变化如图所示:
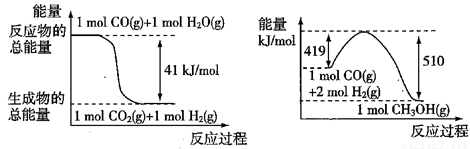
由二氧化碳和氢气制备甲醇的热化学方程式为 。
②为探究用CO2来生产燃料甲醇的反应原理,现进行如下实验:在一恒温恒容密闭容器中,充入1mol CO2和3mol H2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如图1所示,从反应开始到平衡,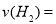 .
.
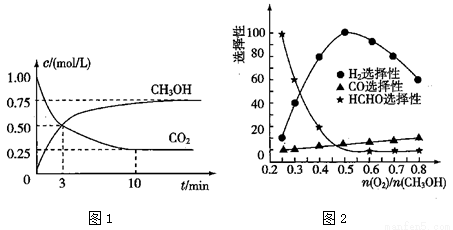
(3)工业上可利用甲醇部分氧化法制取氢气。在一定温度下以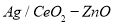 为催化剂时原料气比例对反应的选择性(选择性越大,表示生成的该物质越多)影响关系如图2所示。在制备H2时最好控制
为催化剂时原料气比例对反应的选择性(选择性越大,表示生成的该物质越多)影响关系如图2所示。在制备H2时最好控制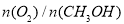 = 。
= 。
查看答案和解析>>
科目:高中化学 来源:2016届安徽省安庆市高三上学期第一次质检化学试卷(解析版) 题型:简答题
工业上可利用“甲烷蒸气转化法生产氢气”,反应为:
CH4(g)+H2O(g)  CO(g)+3H2(g)
CO(g)+3H2(g)
已知温度、压强和水碳比[n(H2O)/n(CH4)]对甲烷平衡含量(%)的影响如下图1:

图1 (水碳比为3) 图2 (800℃)
(1)CH4(g)+H2O(g)  CO(g)+3H2(g)。的
CO(g)+3H2(g)。的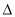 H 0(填“>”或“<”);若在恒温、恒压时,向该平衡体系中通入氦气平衡将 移动(填“向正应方向”、“向逆反应方向”或“不”)。
H 0(填“>”或“<”);若在恒温、恒压时,向该平衡体系中通入氦气平衡将 移动(填“向正应方向”、“向逆反应方向”或“不”)。
(2)温度对该反应的反应速率和平衡移动的影响是 。
(3)其他条件不变,请在图2中画出压强为2MPa时,甲烷平衡含量(%)与水碳比之间关系曲线。(只要求画出大致的变化曲线)
(4)已知:在700℃,1MPa时,1mol CH4与1mol H2O在2L的密闭容器中反应,6分钟达到平衡,此时CH4的转化率为80%,求这6分钟H2的平均反应速率和该温度下反应的平衡常数是多少?(写出计算过程,结果保留小数点后一位数字。)
查看答案和解析>>
科目:高中化学 来源:2016届吉林省扶余市高三上学期第一次月考化学试卷(解析版) 题型:填空题
(1)(8分)某无色溶液含下列8种离子中某几种:Na+、H+、Mg2+、Ag+、Cl-、OH-、
HCO3-、NO3-。已知该溶液可与Al2O3反应,则:
① 若溶液与Al2O3反应,有Al3+生成,则溶液一定有________,一定不含有________。
② 若溶液与 Al2O3反应,有AlO2-生成,则溶液一定有________,可能含有________。
(2)(5分)有五瓶损坏标签的试剂,分别盛有AgNO3溶液、稀硝酸、盐酸、氯化钡溶液、碳酸钾溶液,为了确定各瓶中是什么试剂,将它们任意编号为A、B、C、D、E,
用小试管各盛少量多次进行两两混合反应,反应现象为:A与B、A与E产生沉淀,B与D、B与E产生沉淀,C与E、D与E产生气体,而C与D无反应现象。
由此,可判定各试剂瓶中所盛试剂为:
A________,B________,C________,D________,E________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省高二上学期第一次月考化学试卷(解析版) 题型:实验题
用中和滴定法测定烧碱的纯度(烧碱中的杂质不和酸反应),请根据实验回答:
(1)将称量好的8.8g烧碱样品配制成500mL待测液,配制过程使用的主要仪器除500mL容量瓶、量筒、烧杯、胶头滴管外,还有一种必须使用的仪器是___________。
(2)用_______式滴定管量取10.00mL待测液于锥形瓶中,滴入几滴酚酞。
(3)用0.20mol•L-1的标准盐酸滴定待测液,判断滴定终点的现象是:_________。
(4)如果实验操作正确,从滴定开始到结束,溶液中的离子浓度关系可以出现的是_______(填答案字母序号)
A.c(Na+)>c(Cl-)>c(H+)>c(OH-)
B.c(Na+)>c(OH-)>c(Cl-)>c(H+)
C.c(Na+)+c(H+)=c(OH-)+c(Cl-)
D.c(Cl-)+c(Na+)>c(OH-)+c(H+)
(5)根据下列数据计算,c(NaOH)_______mol/L,烧碱的纯度为________%(保留整数)
滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
滴定前读数(mL) | 滴定后读数(mL) | ||
第一次 | 10.00 | 0.60 | 20.50 |
第二次 | 10.00 | 3.00 | 23.10 |
(6)经过分析发现,本次实验的测定结果比烧碱的实际纯度偏高,造成误差的可能原因是_________(填答案字母序号,错选此题为0分)
A.滴定前平视,滴定后俯视
B.未用标准液润洗滴定管
C.用待测液润洗锥形瓶
D.不小心将标准液滴在锥形瓶外面
E.滴定接近终点时,用少量蒸馏水冲洗锥形瓶内壁
F.滴定前尖嘴有气泡,滴定后消失
查看答案和解析>>
科目:高中化学 来源:2016届山西省校高三上学期阶段性考试化学试卷(解析版) 题型:选择题
能正确表示下列反应的离子方程式的是
A.铝与硫酸铜溶液反应:Al+Cu2+=Al3++Cu
B.碳酸钡溶于稀硝酸:CO32-+2H+=H2O+CO2↑
C.铁与稀盐酸反应:Fe+2H+=Fe3++H2↑
D.醋酸除水垢:2CH3COOH+CaCO3=2CH3COO-+Ca2++CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高二上期中考试化学试卷(解析版) 题型:填空题
(每空2分,共10分)铁元素是重要的金属元素,单质铁在工业和生活中使用得最为广泛。铁还有很多重要的化合物及其化学反应。
如铁与水反应:3Fe(s)+4H2O(g)=Fe3O4(s)+4H2(g) △H
(1)上述反应的平衡常数表达式K=_____________。
(2)已知:①3Fe(s)+2O2(g)=Fe3O4(s) △H1=-1118.4kJ·mol-1
②2H2(g)+O2(g)=2H2O(g) △H2=-483.8 kJ·mol-1
③2H2(g)+O2(g)=2H2O(l) △H3=-571.8 kJ·mol-1
则△H=_____________。
(3)在t℃时,该反应的平衡常数K=16,在2L恒温恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
Fe | H2O(g) | Fe3O4 | H2 | |
甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
乙/mol | 1.0 | 1.5 | 1.0 | 1.0 |
①甲容器中H2O的平衡转化率为_____________(结果保留一位小数)。
②下列说法正确的是_____________(填编号)
A.若容器压强恒定,则反应达到平衡状态
B.若容器内气体密度恒定,则反应达到平衡状态
C.甲容器中H2O的平衡转化率大于乙容器中H2O的平衡转化率
D.增加Fe3O4就能提高H2O的转化率
(4)若将(3)中装置改为恒容绝热(不与外界交换能量)装置,按下表充入起始物质,起始时与平衡后的各物质的量见表:
Fe | H2O(g) | Fe3O4 | H2 | |
起始/mol | 3.0 | 4.0 | 0 | 0 |
平衡/mol | m | n | p | q |
若在达平衡后的装置中继续加入A、B、C三种状况下的各物质,见表:
Fe | H2O(g) | Fe3O4 | H2 | |
A/mol | 3.0 | 4.0 | 0 | 0 |
B/mol | 0 | 0 | 1 | 4 |
C/mol | m | n | p | q |
当上述可逆反应再一次达到平衡状态后,上述各装置中H2的百分含量按由大到小的顺序排列的关系是___________(用A、B、C表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com