
���к͵ζ����ⶨ�ռ�Ĵ��ȣ��ռ��е����ʲ����ᷴӦ���������ʵ��ش�
��1���������õ�8.8g�ռ���Ʒ���Ƴ�500mL����Һ�����ƹ���ʹ�õ���Ҫ������500mL����ƿ����Ͳ���ձ�����ͷ�ι��⣬����һ�ֱ���ʹ�õ�������___________��
��2����_______ʽ�ζ�����ȡ10.00mL����Һ����ƿ�У����뼸�η�̪��
��3����0.20mol•L-1�ı�����ζ�����Һ���жϵζ��յ�������ǣ�_________��
��4�����ʵ�������ȷ���ӵζ���ʼ����������Һ�е�����Ũ�ȹ�ϵ���Գ��ֵ���_______�������ĸ��ţ�
A��c��Na+����c��Cl������c��H������c��OH����
B��c��Na+����c��OH������c��Cl������c��H����
C��c��Na+��+c��H����=c��OH����+c��Cl����
D��c��Cl����+c��Na+����c��OH����+c��H����
��5�������������ݼ��㣬c��NaOH��_______mol/L���ռ�Ĵ���Ϊ________%������������
�ζ����� | ����Һ�����mL�� | �����������mL�� | |
�ζ�ǰ������mL�� | �ζ��������mL�� | ||
��һ�� | 10.00 | 0.60 | 20.50 |
�ڶ��� | 10.00 | 3.00 | 23.10 |
��6�������������֣�����ʵ��IJⶨ������ռ��ʵ�ʴ���ƫ�ߣ�������Ŀ���ԭ����_________�������ĸ��ţ���ѡ����Ϊ0�֣�
A���ζ�ǰƽ�ӣ��ζ�����
B��δ�ñ�Һ��ϴ�ζ���
C���ô���Һ��ϴ��ƿ
D����С�Ľ���Һ������ƿ����
E���ζ��ӽ��յ�ʱ������������ˮ��ϴ��ƿ�ڱ�
F���ζ�ǰ���������ݣ��ζ�����ʧ

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2016�콭��ʡ�����и�����ѧ��9���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
�йػ�ѧ������ȷ����
A��������27����-60ԭ�ӣ�
B���Ȼ�淋ĵ���ʽ��
C��S2���Ľṹʾ��ͼ��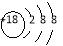
D��Cl���ĵ����Ų�ʽ��1s22s22p63s23p5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ��㶫ʡ��һ��ѧ�ڵ�һ���¿���ѧ�Ծ��������棩 ���ͣ������
��ÿ��2�֣���10�֣�ʵ������Ҫ����400mL0.2mol/L����������Һ��ʵ�鲽������У�
A������ƽ�ϳƳ�___________g�����ƹ��壬���������ձ��������������ˮ�ܽ⡣
B���ѵõ�����ҺС�ĵ����Ų�����ע��________mL������ƿ�С�
C������������ˮϴ���ձ��Ͳ�����2��3�Σ�ÿ��ϴ��ҺҲС��ת������ƿ�С�
D������������ƿ�м�����ˮ��Һ���̶�l��2cm��������_______________С�ĵμ�����ˮ����Һ��Һ��ײ���̶���ˮƽ���С�
E����ƿ�����������ҡ�ȡ�
F������õ���Һ�����Լ�ƿ�У����ϱ�ǩ����ϴ������ƿ��
��1������д�����հ״���
��2�����������ʹ������ҺŨ��ƫ�ߵ���___________������ţ���
������ƿ��ǰ�ڱ�մ��ˮ�� ��û�н��������IJ�������C ��δ��ȴ�����¾�ע������ƿ���� �ܶ���ʱ��ˮ�Ӷ��ˣ��õι����� �ݶ���ʱ����������ƿ�̶��� ����ʱ����������ƿ�̶���
��3�����ʵ������98����Ũ���ᣨ�ܶ�Ϊ1.8g��cm-3�� ���� 3.6mol��L-1��ϡ����150mL����������Ũ��������Ϊ___________mL��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�찲��ʡ������ѧ�ڵڶ����¿���ѧ�Ծ��������棩 ���ͣ������
ij����Һ����Ҫ�ɷ�Ϊ NaClO����������NaCl����������Ӧ�Ļ�ѧ����������������ʵ��
��1��������Һ����NaOH ��Һ����Cl2 �Ʊ�����ѧ����ʽΪ_______________________��
��2��������Һ��pH ԼΪ12�����ӷ���ʽΪ__________________________��
��3����FeSO4 ��Һ�е�����������Һ����Һ��ɫ����ػ�ɫ����Ӧ�����ӷ���ʽΪ______________��
��4��������Һ���������飨��Ҫ�ɷ�ΪŨ���ᣩ���ã����������ж�Σ�ա�ÿ����1 mol Cl2����״���£���ת�Ƶ��Ӹ���ԼΪ________________ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�켪��ʡ�����и�����ѧ�ڵ�һ���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
N2O�׳ơ�Ц��������������������������������N2O��Ӧ��3CO+2NO2�T3CO2+N2O������˵����ȷ����
A����Ӧ��ÿ����l mol N2O��ת��4mol����
B��N2Oֻ�������ԣ���ԭ��
C��N2O��CO2��Ϊ�ȵ�����
D��NO2��������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016��ӱ�ʡ�����и�����ѧ��10���¿���ѧ�Ծ��������棩 ���ͣ������
��ͼΪԪ�����ڱ���һ���֣������Ԫ�آ١����ڱ��е�λ�ã��ش��������⣺

��1������ijԪ����������������ˮ���������⻯��֮�������Ӧ�������ӻ����������ӻ������������______����Ԫ�آܡ��ޡ��ߡ����γɵļ����ӵİ뾶�ɴ�С��˳����_______�������ӷ��ű�ʾ����ͬ�����ڡ��ܡ���Ԫ�ص��⻯��ķе��ɸߵ��͵�˳����____________��
��2���ֱ�����������Ԫ����ɡ���Ϊ10e-�����������ӣ��ڼ��������·�Ӧ��������10e-�ķ��ӣ�д�������ӷ�Ӧ������________________��
��3���ɱ�������Ԫ���γ�X��Y��Z��M��N�ȳ������ʣ�X��Y����һ����ͬԪ�أ�����X��ɫ��Ӧ�ʻ�ɫ���ɷ������·�Ӧ��
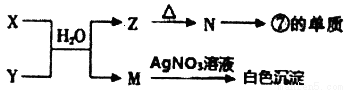
�� X��Y��ˮ��Ϻ�Ӧ�����ӷ���ʽΪ________________��
�� N���ߵĵ��ʷ�Ӧ�Ļ�ѧ����ʽΪ_________________��
�� Ԫ�آ��γɵĵ��ʵĵ���ʽΪ________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016��ɽ��ʡ�Ͳ��и�����ѧ��10���¿���ѧ�Ծ��������棩 ���ͣ������
��11�֣�ij��ɫϡ��ҺX�У����ܺ����±����������е�ij���֡�
������ | CO32����SiO32����AlO2����Cl�� |
������ | Al3+��Fe3+��Mg2+��NH4+��Na+ |
��ȡ����Һ�����������м���ij�Լ�Y�������������ʵ�����n��������Լ��������V����ϵ��ͼ��ʾ��
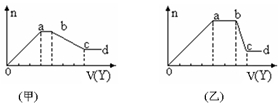
��1����Y�����ᣬ���õ��Ĺ�ϵͼ�����ʾ����oa��ת��Ϊ���������ӣ�ָ��Դ��X��Һ�ģ���ͬ���� ��ab�η�����Ӧ������ ��bc�η�����Ӧ�����ӷ���ʽ ��
��2����Y��NaOH��Һ�����õ��Ĺ�ϵͼ������ʾ����X��һ�����е������� ������X��Һֻ���⼸�����ӣ�����Һ���������ʵ���֮��Ϊ ��ab�η�Ӧ�����ӷ���ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�츣��ʡ�ĵ���У������ѧ�ڵ�һ��������ѧ�Ծ��������棩 ���ͣ�ѡ����
����һ�����˵������������ص�Ԫ�أ���֪I2������NaOH��KI��Һ����Ӧ����ʽ�ֱ�Ϊ��3I2+6OH���T5I��+IO3-+3H2O��HIO���ȶ��������绯��Ӧ����I2+I���TI3-���廯�⣨IBr����һ��±�ػ����������±�ص������Ƶ����ʣ����з�Ӧ����ʽ�в���ȷ����
A��IBr����Na2S��Һ�в�����ɫ���ǣ�IBr+S2���TI��+Br��+S��
B��IBr����KI��Һ�У�IBr+2I���TBr��+ I3-
C��IBr����NaOH��Һ�У�IBr+2OH���TBrO��+I��+H2O
D��IBr����AgNO3��Һ�У�3IBr+5Ag++3H2O�T3AgBr��+2AgI��+ IO3-+6H+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ��ɽ��ʡ�߶��ϵ�һ���¿���ѧ�Ծ��������棩 ���ͣ������
��10�֣�ÿ��2�֣���ѧ������̫���ֽܷ�ˮ���ɵ������ڴ����������������̼��Ӧ���ɼ״�����������ֱ���Լ״�Ϊȼ�ϵ�ȼ�ϵ�أ���֪H2(g)��CO(g)��CH3OH(l)��ȼ���Ȧ�H�ֱ�Ϊ-285.8 kJ��mol-1��-283.0 kJ��mol-1��-726.5 kJ��mol-1����ش��������⣺
��1����̫���ֽܷ�180 gˮ���ĵ������� kJ��
��2���״�����ȫȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ����ʽΪ ��
��3�����ݻ�Ϊ2L���ܱ������У���CO2��H2�ϳɼ״����������������������£������¶ȶԷ�Ӧ��Ӱ�죬ʵ��������ͼ��ʾ(ע��T1��T2������300��)��


����˵����ȷ���� (�����)
���¶�ΪT1ʱ���ӷ�Ӧ��ʼ��ƽ�⣬�״���ƽ������Ϊv(CH3OH)= mol��L��1��min��1
mol��L��1��min��1
�ڸ÷�Ӧ��T1ʱ��ƽ�ⳣ����T2ʱ��С
�۸÷�ӦΪ���ȷ�Ӧ
�ܴ���A��ķ�Ӧ��ϵ��T1�䵽T2���ﵽƽ��ʱ ����
����
��4����T1�¶�ʱ(�״�Ϊ��̬)����lmol CO2��3mol H2����һ�ܱպ��������г�ַ�Ӧ�ﵽƽ�����CO2��ת����Ϊ�����������ڵ�ѹǿ����ʼѹǿ֮��Ϊ ��
��5����ֱ���Լ״�Ϊȼ�ϵ�ȼ�ϵ���У��������ҺΪ���ԣ������ķ�ӦʽΪ ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com