
【题目】下表为元素周期表的一部分,请参照元素①~⑥在表中的位置,用化学用语回答下列问题。

(1)元素①的原子结构示意图为_________。
(2)元素③和⑥可形成化合物,用电子式表示形成其过程_________。
(3)元素②、③形成简单离子的半径(填离子符号)_________>_________。
(4)元素②、⑥形成的气态氢化物稳定性(填化学式,下同)______>_______;元素③、④形成的最高价氧化物水化物的碱性_________>_________。
(5)元素④的最高价氧化物与元素⑤最高价氧化物的水化物稀溶液反应的离子方程式__。
【答案】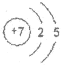
![]() F- Na+ HF HCl NaOH Al(OH)3 Al2O3+6H+=2Al3++3H2O
F- Na+ HF HCl NaOH Al(OH)3 Al2O3+6H+=2Al3++3H2O
【解析】
根据元素周期表中各元素的位置,可以推出:①为N,②为F,③为Na,④为Al,⑤为S,⑥为Cl。
(1)①为N,是7号元素,其原子结构示意图为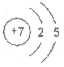 ;
;
(2)③为Na,⑥为Cl,它们形成的化合物为NaCl,其形成过程用电子式可表示为:![]() ;
;
(3)②为F,其简单离子为F-,③为Na,其简单离子为Na+,二者的离子的核外电子排布相同,F-的半径大于Na+的;
(4)②为F,⑥为Cl,由于F的非金属性比Cl强,所以HF稳定大于HCl;③为Na,④为Al,由于Na的金属性比Al强,所以NaOH的碱性比Al(OH)3强;
(5)④为Al,其最高价氧化物为Al2O3,⑤为S,其最高价氧化物的水化物为H2SO4,则该反应的离子方程式为:Al2O3+6H+=2Al3++3H2O


 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:
【题目】从海水提取镁和溴的流程如下,请回答相关问题。

(1)海水进入沉淀池前,对海水进行处理有以下两种方案:
方案一:将晒盐后的卤水通入沉淀池;
方案二:将加热蒸发浓缩后的海水通入沉淀池。
你认为方案_________更合理。操作1的名称_________。
(2)提取镁和溴
①试剂a为_________(填化学式),通入试剂a发生反应的离子方程式_________。
②吹出塔中通入热空气的目的是_________。
③吸收塔中发生反应离子方程式是_________。
④无水MgCl2制备Mg的化学方程式是_____。
(3)提取溴的过程中,经过2次Br-→Br2转化的目的是__。
(4)从海水中提取溴的工艺也可以按如下图所示(框图中是主要产物):

i. 过程③中反应的离子方程式是________。
ii. 若最终得到的溴单质中仍然混有少量的Cl2,应加入_________将其除去。
A. NaI B. NaBr C. SO2 D. NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图装置测定中和热的实验步骤如下:

①用量筒量取50mL 0.25mol/L硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50mL 0.55mol/L NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液的最高温度。
回答下列问题:
(1)仪器A的名称为_________________________。
(2)倒入NaOH溶液的正确操作是________。
A.沿玻璃缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(3)使硫酸与NaOH溶液混合均匀的正确操作是________。
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃棒轻轻地搅动
(4)实验数据如下表:
①请填写下表中的空白:
温度 实验 次数 | 起始温度t1/℃ | 终止 温度 t2/℃ | 温度差 平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | _______ |
2 | 27.0 | 27.4 | 27.2 | 32.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.2 | |
4 | 26.4 | 26.2 | 26.3 | 29.8 | |
②近似地认为0.55mol/L NaOH溶液和0.25mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃),则中和热ΔH = ______ (取小数点后一位)。
③中和热测定实验中,下列操作一定会降低实验准确性的是________。
A.用滴定管(精量仪器,读数保留到0.01)取所用酸碱溶液的体积
B.NaOH溶液在倒入小烧杯时,有少量溅出
C.大、小烧杯体积相差较大,夹层间放的碎泡沫塑料较多
D.测量HCl溶液的温度计用水洗净后才用来测NaOH溶液的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:
温度(℃) | 360 | 440 | 520 |
K值 | 0.036 | 0.010 | 0.0038 |
(1)①写出工业合成氨的化学方程式_________。
②由上表数据可知该反应为放热反应,理由是_________。
③理论上,为了增大平衡时H2的转化率,可采取的措施是_________。(填序号)
a. 增大压强 b. 使用合适的催化剂
c. 升高温度 d. 及时分离出产物中的NH3
(2)原料气H2可通过反应CH4(g)+H2O(g)![]() CO(g)+3H2(g)获取,已知该反应中,当初始混合气中的
CO(g)+3H2(g)获取,已知该反应中,当初始混合气中的![]() 恒定时,温度、压强对平衡混合气CH4含量的影响如下图所示:
恒定时,温度、压强对平衡混合气CH4含量的影响如下图所示:
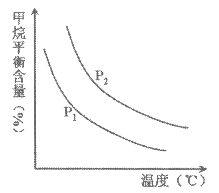
①图中,两条曲线表示压强的关系是:P1_____P2(填“>”、“=”或“<”)。
②该反应为________反应(填“吸热”或“放热”)。
(3)原料气H2还可通过反应CH4(g)+H2O(g)![]() CO(g)+3H2(g)获取。T℃时,向容积固定为5L的容器中充入1mol水蒸气和1mol CO,反应达平衡后,测得CO的浓度为0.08 mol·L-1
CO(g)+3H2(g)获取。T℃时,向容积固定为5L的容器中充入1mol水蒸气和1mol CO,反应达平衡后,测得CO的浓度为0.08 mol·L-1
①平衡时CO的转化率为_________。
②该温度下反应的平衡常数K值为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于元素周期表的说法正确的是
A. 元素周期表有7个主族B. ⅠA族的元素全部是金属元素
C. 元素周期表有7个周期D. 短周期是指第一、二周期
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂—铜空气燃料电池(如图)容量高、成本低,该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为:2Li+Cu2O+H2O=2Cu+2Li++2OH-,下列说法错误的是

A. 整个反应过程中,氧化剂为O2
B. 放电时,正极的电极反应式为:Cu2O+H2O+2e-=2Cu+2OH-
C. 放电时,当电路中通过0.1 mol电子的电量时,有0.1 mol Li+透过固体电解质向Cu极移动,有标准状况下1.12 L氧气参与反应
D. 通空气时,铜被腐蚀,表面产生Cu2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业涉及固体燃料的气化,需要研究CO2与CO之间的转化。为了弄清其规律,让一定量的CO2与足量碳在体积可变的密闭容器中反应:C(s)+CO2(g)![]() 2CO(g) H,测得压强、温度对CO、CO2的平衡组成的影响如图所示:
2CO(g) H,测得压强、温度对CO、CO2的平衡组成的影响如图所示:

回答下列问题:
(1)p1、p2、p3的大小关系是______________,欲提高C与CO2反应中CO2的平衡转化率,应采取的措施为 。图中a、b、c三点对应的平衡常数大小关系是____________。
(2)900 ℃、1.013 MPa时,1 mol CO2与足量碳反应达平衡后容器的体积为V,CO2的转化率为_________,该反应的平衡常数K= 。
(3)将(2)中平衡体系温度降至640 ℃,压强降至0.1013 MPa,重新达到平衡后CO2的体积分数为50%。条件改变时,正反应和逆反应速率如何变化?_______,二者之间有何关系?____________________。
(4)一定条件下,在CO2与足量碳反应所得平衡体系中加入H2和适当催化剂,有下列反应发生:CO(g)+3H2(g)![]() CH4(g)+H2O(g) H1=-206.2 kJ/mol
CH4(g)+H2O(g) H1=-206.2 kJ/mol
CO(g)+H2O(g)![]() CO2(g)+H2(g) H2=-41.2 kJ/mol
CO2(g)+H2(g) H2=-41.2 kJ/mol
① 则二氧化碳与氢气反应转化为甲烷和水蒸气的热化学方程式是_________________。
② 已知298 K时相关化学键键能数据为:
化学键 | H—H | O—H | C—H |
|
E/(kJ·mol-1) | 436 | 465 | 413 | 1076 |
则根据键能计算,H1= ,它与上述实测值差异较大的原因可能是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%,二氧化碳(CO2)的排放量也要大幅减少。

(1)在恒温,容积为1 L容器中,硫可以发生如下转化,其反应过程和能量关系如图1所示。已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196.6 kJ·mol-1,回答下列问题:
2SO3(g) ΔH=-196.6 kJ·mol-1,回答下列问题:
①写出能表示硫的燃烧热的热化学方程式: _____________________________
②ΔH2=__________kJ·mol-1。
③在相同条件下,充入1 mol SO3和0.5 mol的O2,则达到平衡时SO3的转化率为___________;此时该反应________(填“放出”或“吸收”)________kJ的能量。
(2)中国政府承诺,到2020年单位GDP二氧化碳排放比2005年下降40%~50% 。
①CO2可转化成有机物实现碳循环。在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,测得CO2和CH3OH(g)浓度随时间变化如图2所示。从3 min到9 min,v(H2)=________mol·L-1·min-1。此条件下该反应的平衡常数为__________
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,测得CO2和CH3OH(g)浓度随时间变化如图2所示。从3 min到9 min,v(H2)=________mol·L-1·min-1。此条件下该反应的平衡常数为__________

②能说明上述反应达到平衡状态的是______(填编号)
A、反应中CO2与CH3OH的物质的量浓度之比为1∶1(即图中交叉点)
B、混合气体的密度不随时间的变化而变化
C、CO2的体积分数在混合气体中保持不变
D、单位时间内消耗3 mol H2,同时消耗1 mol H2O
③为了加快化学反应速率且使体系中气体的物质的量减少,其他条件不变时,可采取的措施有________(填编号)。
A.升高温度B.缩小容器体积C.再充入CO2气体D.使用合适的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组为了探究一种无机矿物质X(仅含四种元素)的组成和性质,设计并完成如下实验:

另取10.80gX在惰性气流中加热至完全分解,得到6.40g固体1.请回答如下问题:
(1)画出白色沉淀1中金属元素的原子结构示意图_______,写出气体甲的电子式_______。
(2)X的化学式是______,在惰性气流中加热X至完全分解的化学反应方程式为_______。
(3)白色沉淀2在空气中变成红褐色沉淀的原因是_______(用化学反应方程式表示)。
(4)一定条件下,气体甲鱼固体1中的某种成分可能发生氧化还原反应,写出一个可能的化学反应方程式_______,并设计实验方案验证该反应的产物_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com