
【题目】实验室制取氯气的化学方程式:4HCl(浓)+MnO2 ![]() Cl2↑+MnCl2 +2H2O ,
Cl2↑+MnCl2 +2H2O ,
(1)反应物HCl中氯元素的化合价____,HCl在反应中表现的性质包括_______和______。
(2)在该氧化还原反应中,MnO2 做_________剂,锰元素被________。
(3)写出该反应的离子方程式,并用单线桥法标出电子转移的方向和数目:_______________________。
【答案】-1 还原性 酸性 氧化 还原 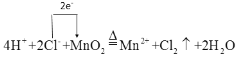
【解析】
(1)根据正负化合价代数和为0判断;还原剂具有还原性,化合价升高,失电子,被氧化;
(2)氧化剂具有氧化性,化合价降低,得电子,被还原;
(3)根据电荷守恒,得失电子数相等,原子守恒书写离子方程式;单线桥法箭头由还原剂指向氧化剂,根据化合价的变化写出转移电子数。
(1)反应物HCl中H为+1价,氯元素的化合价为-1价;HCl中有1/2的氯离子化合价升高失电子生成氯气,显示还原性;1/2的氯离子以酸根离子形式存在,显示酸性;
(2)在该氧化还原反应中,Mn元素的化合价降低,MnO2做氧化剂,锰元素被还原;
(3)只有溶于水的强电解质可以拆写成离子形式,故该反应的离子方程式为4H++2Cl-+MnO2![]() Mn2++Cl2↑+2H2O;根据方程式可知反应中转移电子数为2e-,单线桥法标出电子转移的方向和数目为
Mn2++Cl2↑+2H2O;根据方程式可知反应中转移电子数为2e-,单线桥法标出电子转移的方向和数目为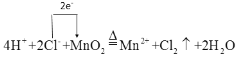 。
。


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
【题目】废水中过量的氨氮(NH3和NH4+)会导致水体富营养化。某科研小组用NaClO氧化法处理氨氮废水。已知:①HClO的氧化性比NaClO强;②NH3比NH4+更易被氧化;③国家标准要求经处理过的氨氮废水pH要控制在6~9。
(1)pH=1.25时,NaClO可与NH4+反应生成N2等无污染物质,该反应的离子方程式为_____。
(2)进水pH对氨氮去除率和出水pH的影响如下图所示

①进水pH为1.25~2.75范围内,氨氮去除率随pH升高迅速下降的原因是_____
②进水pH为2.75~6.00范围内,氨氮去除率随pH升高而上升的原因是_____
③进水pH应控制在_____左右为宜。
(3)为研究空气对NaClO氧化氨氮的影响,其他条件不变,仅增加单位时间内通入空气的量,发现氨氮去除率几乎不变。其原因可能是_____(填字母)。
a.O2的氧化性比NaClO弱 b.O2氧化氨氮速率比NaClO慢
c.O2在溶液中溶解度比较小 d.空气中的N2进入溶液中
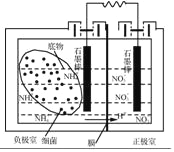
(4)利用微生物燃料电池可以对氨氮废水进行处理,其装置如图所示。闭合电路后,负极室与正极室均产生氮气,则负极室中NH4+发生反应的电极反应式为_____。该装置除了能对氨氮废水进行处理外,另一个突出的优点是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,某反应达平衡,平衡常数K=c(CO).c(H2O)/[c(CO2).c(H2)]。保持容器容积不变,升高温度,H2浓度减小,则下列说法不正确的是
A. 该反应的焓变为正值
B. 恒温恒容下,再充入CO2气体,H2浓度一定减小
C. 升高温度,会使正反应速率增大,逆反应速率减小,平衡正移
D. 该反应化学方程式为CO2+H2![]() CO+H2O
CO+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钒被誉为“合金的维生素”。从废钒(主要成分为V2O5、Fe2O3、SiO2等)中回收V2O5的一种工艺流程如下图所示:

已知:
步骤②、③中的变化过程可简化为:Rn+(水层)+nHA(有机层)![]() RAn(有机层)+nH+(水层)(式中Rn+表示VO2+或Fe3+,HA表示有机萃取剂)
RAn(有机层)+nH+(水层)(式中Rn+表示VO2+或Fe3+,HA表示有机萃取剂)
回答下列问题:
(1)步骤D酸浸过程中发生氧化还原反应的化学方程式为______________________。
(2)萃取时应加入适量碱的作用是___________________。
(3)步骤④中反应的离子方程式为___________________。
(4)步骤⑤加入氨水调节溶液pH=2,钒沉淀率达到93%且不产生Fe(OH)3沉淀,则此时溶液中c(Fe3+)<_____mol/L(按25℃计算,25℃时Ksp[Fe(OH)3]=2.6×10-39)。所得NH4VO3为离子化合物,NH4+的电子式为_______。
(5)V2O5是两性氧化物,在强酸性溶液中以VO2+形式存在,VO2+具有强氧化性,能将I-氧化为I2,本身被还原为V0+,则V2O5与氢碘酸反应的离子方程式为_________________。
(6)为提高钒的回收率,步骤②和③需多次进行,假设酸浸所得“强酸性浸出液”中c(VO2+)=amol/L,步骤②和③每进行一次,VO2+萃取率为80%,4次操作后,“强酸性浸出液中”c(VO2+)=_______mol/L(萃取的量=![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,在容积为2L的恒容密闭容器中,将2molN气体和3molM气体相混合,发生如下反应:2N(g)+3M(g)![]() xQ(g)+3R(g),4s后该反应达平衡时,生成2.4molR,并测得Q的反应速率为0.1mol/(L·s),下列有关叙述正确的是
xQ(g)+3R(g),4s后该反应达平衡时,生成2.4molR,并测得Q的反应速率为0.1mol/(L·s),下列有关叙述正确的是
A. N的转化率为80% B. 0~4s内,混合气体的平均相对分子质量不变
C. x值为2 D. 平衡时M的浓度为0.6mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“探险队员”——盐酸,不小心走进了化学迷宫,不知怎样走出来,因为迷宫有许多“吃人的野兽”(即能与盐酸反应的物质),盐酸必须避开它们,否则就无法通过。

(1)请你帮助它走出迷宫(请用图中物质前的序号连接起来表示所走的路线):_____________。
(2)在能“吃掉”盐酸的化学反应中,属于酸和碱中和反应的有________个,其中能“吃掉”盐酸的盐是________,能“吃掉”盐酸的氧化物有________.
(3)在不能与盐酸反应的物质中,属于氧化物的是______(填写物质序号,下同),属于单质的是____。
(4)如果将盐酸换成氧气,它能沿着盐酸走出的路线“走出”这个迷宫吗?为什么? _________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如下:
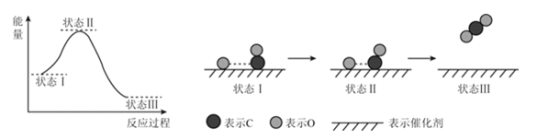
下列说法中正确的是
A. CO和O生成CO2是吸热反应 B. 在该过程中,CO断键形成C和O
C. CO和O生成了CO2 D. 状态Ⅰ→状态Ⅲ表示CO与O2反应的过程
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com