
【题目】在一定条件下,在容积为2L的恒容密闭容器中,将2molN气体和3molM气体相混合,发生如下反应:2N(g)+3M(g)![]() xQ(g)+3R(g),4s后该反应达平衡时,生成2.4molR,并测得Q的反应速率为0.1mol/(L·s),下列有关叙述正确的是
xQ(g)+3R(g),4s后该反应达平衡时,生成2.4molR,并测得Q的反应速率为0.1mol/(L·s),下列有关叙述正确的是
A. N的转化率为80% B. 0~4s内,混合气体的平均相对分子质量不变
C. x值为2 D. 平衡时M的浓度为0.6mol/L
【答案】A
【解析】
A.根据化学方程式中计量数之比,结合R的物质的量,计算参加反应N的物质的量,N的转化率=![]() ×100%;
×100%;
B.根据生成的R的物质的量,利用物质的量之比等于化学计量数之比计算生成的Q的物质的量,确定反应为气体体积缩小的反应,随着反应的进行混合气体的平均分子质量减小;
C.根据v=cVt计算生成Q的物质的量,结合R的物质的量,利用物质的量之比等于化学计量数之比计算x的值;
D.根据生成的R的物质的量,利用物质的量之比等于化学计量数之比计算参加反应的M的物质的量,M的平衡浓度=![]() 。
。
A.平衡时生成R为2.4mol,参加反应的N的物质的量为![]() 1.6mol,则N的转化率为
1.6mol,则N的转化率为![]() ×100%=80%,选项A正确;
×100%=80%,选项A正确;
B、平衡时生成的Q的物质的量为0.1mol/(L·s)×2L×4s =0.8mol,生成R为2.4mol,物质的量之比等于化学计量数之比,故0.8mol:2.4mol=x:3,解得x=1,反应为气体体积的缩小的反应,0~4s内,随着反应的进行,气体的总物质的量减小,混合气体的平均相对分子质量减小,选项B错误;
C.平衡时生成的Q的物质的量为0.1mol/Ls×2L×4s=0.8mol,生成R为2.4mol,物质的量之比等于化学计量数之比,故0.8mol:2.4mol=x:3,解得x=1,选项C错误;
D.反应达到平衡时,生成2.4molR,由方程式可知,参加反应的M的物质的量为2.4mol,故平衡时M的物质的量为3mol-2.4mol=0.6mol,M的平衡浓度为=![]() 0.3mol/L,选项D错误;
0.3mol/L,选项D错误;
答案选A。


科目:高中化学 来源: 题型:
【题目】K4[Fe(CN)6]可用于生产油漆、药物等。
(1)Fe2+的核外电子排布式为_____。
(2)CN﹣中C原子轨道的杂化类型为_____。与CN﹣互为等电子体的一种分子的结构式为_____。
(3)[Cu(H2O)4]2+结构示意图如图所示。[Fe(CN)6]4﹣结构示意图如图所示,请在图中相应位置补填配体_________。

(4)已知3K4Fe(CN)6![]() 12KCN+Fe3C+3C+(CN)2↑+2N2↑.(CN)2分子中σ键与π键的数目比n(σ):n(π)=_____。
12KCN+Fe3C+3C+(CN)2↑+2N2↑.(CN)2分子中σ键与π键的数目比n(σ):n(π)=_____。
(5)铁触媒是合成氨反应的催化剂,其表面存在氮原子。氮原子在铁表面上的单层附着局部示意如图所示。则铁表面上氮原子与铁原子的数目比为_____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图为H2与O2反应生成H2O(g)的能量变化示意图:

下列有关叙述不正确的是
A. 1molH2分子断键需要吸收436kJ的能量
B. H2(g)+1/2O2(g)=H2O(g)ΔH=-241.8kJ/mol
C. 分解1mol气态水生成氢气和氧气总共需要吸收926.8kJ的热量
D. 形成化学键释放的总能量比断裂化学键吸收的总能量大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,含有相同氧原子数的![]() 与CO气体,下列叙述正确的( )
与CO气体,下列叙述正确的( )
A.物质的量之比为2:1B.体积之比为1:2
C.质量之比为16:7D.密度之比为7:16
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取氯气的化学方程式:4HCl(浓)+MnO2 ![]() Cl2↑+MnCl2 +2H2O ,
Cl2↑+MnCl2 +2H2O ,
(1)反应物HCl中氯元素的化合价____,HCl在反应中表现的性质包括_______和______。
(2)在该氧化还原反应中,MnO2 做_________剂,锰元素被________。
(3)写出该反应的离子方程式,并用单线桥法标出电子转移的方向和数目:_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20 mL 0.2 mol·L-1二元酸H2A溶液中滴加0.2 mol·L-l NaOH溶液,有关微粒物质的量变化如图。下列叙述正确的是( )
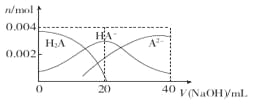
A. 当V(NaOH)="20" mL时,溶液中各离子浓度的大小顺序为:c(Na+)>c(HA-)>c( A2-)>c( OH-)> ((H+)
B. 等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水中的大
C. 等浓度H2A和NaHA的混合溶液中无论加入少量的强酸或强碱,溶液的pH变化都不大
D. 当V(NaOH) ="40" mL时,升高温度,c(Na+)/c(A2-)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、硫及其化合物在工农业生产生活中有着重要作用。回答下列问题:
(1)有人设想利用CO还原SO2。已知S和CO的燃烧热分别是296.0 kJ·mol1、283.0 kJ·mol1,请写出CO还原SO2的生成CO2和S(s)热化学方程式___________________________________。
(2)某科研小组研究臭氧氧化碱吸收法同时脱除SO2和NO工艺,氧化过程反应原理及反应热、活化能数据如下:
反应Ⅰ:NO(g)+O3(g)![]() NO2(g)+O2(g) △H1=-200.9 kJmol1 Ea1=3.2 kJmol1
NO2(g)+O2(g) △H1=-200.9 kJmol1 Ea1=3.2 kJmol1
反应Ⅱ:SO2(g)+O3(g)![]() SO3(g)+O2(g) △H2=-241.6 kJmol1 Ea2=58 kJmol1
SO3(g)+O2(g) △H2=-241.6 kJmol1 Ea2=58 kJmol1
已知该体系中臭氧发生分解反应:2O3(g)![]() 3O2(g)。请回答:
3O2(g)。请回答:
其它条件不变,每次向容积为2 L的反应器中充入含2.0 mol NO、2.0 mol SO2的模拟烟气和4.0 mol O3,改变温度,反应相同时间t后体系中NO和SO2的转化率如图所示:

①由图1可知相同温度下NO的转化率远高于SO2,结合题中数据分析其可能原因_______。
②下列说法正确的是________。
A.Q点一定为平衡状态点
B.温度高于200℃后,NO和SO2的转化率随温度升高显著下降、最后几乎为零
C.其它条件不变,若扩大反应器的容积可提高NO和SO2的转化率
D.臭氧氧化过程不能有效地脱除SO2,但后续步骤碱吸收可以有效脱硫
③假设100℃时P、Q均为平衡点,此时反应时间为5min,发生分解反应的臭氧占充入臭氧总量的10%,则体系中剩余O3的物质的量是________mol;SO2的平均反应速率为________;反应Ⅰ在此时的平衡常数为_______________。
(3)以连二硫酸根(S2O42-)为媒介,使用间接电化学法也可处理燃煤烟气中的NO,装置如图所示:

①ab是_______离子交换膜(填“阳”或“阴”)。阴极区的电极反应式为_____________。
②若NO吸收转化后的产物为NH4+,通电过程中吸收4.48LNO(标况下),则阳极可以产生____mol气体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】保护环境,提倡“低碳生活”,是我们都应关注的社会问题。
(1)目前,一些汽车已改用天然气(CNG)做燃料,以减少对空气污染。
①16g甲烷完全燃烧生成液态水放出890kJ热量,则甲烷燃烧的热化学方程式是__________。
②1mol碳完全燃烧生成二氧化碳气体放出393.5kJ热量,通过计算比较,填写下列表格(精确到0.01):
物质质量1g | 燃烧放出的热量/kJ | 生成CO2的质量/g |
碳 | 32.80 | ____________ |
甲烷 | ____________ | 2.75 |
根据表格中的数据,天然气与煤相比,用天然气做燃料的优点是__________。
(2)为了减少二氧化碳的排放,利用海藻可将二氧化碳、氢气转化成水及一种可以再生的绿色能源乙醇,该反应的化学方程式是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.常温下0.1mol·L-1的盐酸和pH=1的醋酸各100mL分别与足量的锌粒反应,产生的气体前者比后者_____(填“>”“<”或“=”)。
II.现有常温下pH=2的HCl溶液甲和pH=2的CH3COOH溶液乙,请根据下列操作回答问题:
(1)常温下0.1mol·L-1的CH3COOH溶液加水稀释过程中,下列表达式的数据一定变小的是_____。
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)c(OH-) D.c(OH-)/c(H+)
(2)取10mL的乙溶液,加入等体积的水,CH3COOH的电离平衡________(填“向左”“向右”或“不”)移动;另取10mL的乙溶液,加入少量无水醋酸钠固体(假设加入固体前后溶液体积保持不变),待固体溶解后,溶液中c(H+)/c(CH3COOH)的比值将________(填“增大”“减小”或“无法确定”)。
(3)取等体积的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和,则消耗NaOH溶液体积的大小关系为V(甲)__ V(乙) (填“>”“<”或“=”)。
(4)已知25℃时,下列酸的电离平衡常数如下:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=4.7×10-11 | 3.0×10-8 |
下列四种离子结合H+能力最强的是________。
A.HCO3— B.CO32— C.ClO- D.CH3COO-
写出下列反应的离子方程式:HClO+Na2CO3(少量):______________________。
Ⅲ.室温下,0.1 mol·L-l的KOH溶液滴10.00mL 0.10 mol·L-l H2C2O4 (二元弱酸)溶液,所得滴定曲线如图(混合溶液的体积可看成混合前溶液的体积之和)。请回答下列问题:

(1)点③所示溶液中所有离子的浓度由大到小的顺序为:_____________________。
(2)点④所示溶液中:c(K+)+c(H2C2O4)+c(HC2O4)+c(C2O42)=________mol/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com