
【题目】常温下,HNO2的电离平衡常数为K=4.6×10-4(已知![]() 2.14),向20mL0.01molL-1HNO2溶液中逐滴加入相同浓度的NOH溶液,测得混合液的 pH随NaOH溶液体积的变化如图所示,下列判断正确的是
2.14),向20mL0.01molL-1HNO2溶液中逐滴加入相同浓度的NOH溶液,测得混合液的 pH随NaOH溶液体积的变化如图所示,下列判断正确的是

A. X=20
B. a、b、c、d四点对应的溶液中水的电离程度逐渐减小
C. a点溶液中c(H-)=2.14×10-3molL-1
D. b点溶液中微粒浓度的大小关系为c(HNO2)>c(Na+)>c(NO2-)
【答案】C
【解析】
HNO2的电离平衡常数为K=4.6×10-4,亚硝酸为弱酸存在电离平衡,电离方程式为HNO2NO2-+H+。逐滴加入相同浓度的NaOH溶液,b点HNO2消耗一半,溶质为HNO2、NaNO2。当加入20mLNaOH,溶质是NaNO2,由于为弱酸强碱盐,会水解使溶液偏碱性。据此分析回答。
A.向20mL0.01molL-1的HNO2溶液中逐滴加入相同浓度的NaOH溶液,若恰好反应需要氢氧化钠溶液体积20ml,溶质是NaNO2,由于为弱酸强碱盐,会水解使溶液显碱性,而c点是溶液呈中性,所以X<20mL,故A不正确;
B.c点是溶液呈中性,溶质为HNO2、NaNO2混合溶液。氢氧化钠溶液体积为20ml时恰好反应,那么从a开始到恰好完全反应时,水的电离程度逐渐增大。d点从图中无法判断出是在恰好反应之前还是恰好反应之后,故B不正确;
C.由HNO2NO2-+H+, ![]() ,
,![]() ,得到c(H+)=2.14×10-3mol·L-1,故C正确;
,得到c(H+)=2.14×10-3mol·L-1,故C正确;
D.b点溶液为HNO2、NaNO2混合溶液,且浓度比为1:1;溶液中存在NO2-+H2OHNO2+OH-,HNO2H++NO2-,因为溶液呈酸性,所以电离程度大于水解程度,离子浓度大小为c(NO2-)>c(Na+)>c(HNO2),故D不正确。
答案:C


科目:高中化学 来源: 题型:
【题目】铁及其化合物在人类的生活生产中有着重要的作用,Fe2+、Fe3+是影响水质的一个重要因素。回答下列问题:
I:测量某河水样本中铁的含量
(1)水样中Fe2+的含量越大,溶解氧的含量就越低,用离子方程式解释原因___________。
(2)测定Fe2+取5mL c mo/L的KMnO4标准液,稀释至100mL。取10.00mL河水水样,加入稀硫酸后,用稀释后的KMnO4溶液进行滴定,用去KMnO4溶液V1mL。
①用___________(填滴定管的名称)盛放KMnO4标准液。
②滴定达到终点的标志是___________。
(3)测定Fe3+:取10.00mL水样,转移至盛有过量锌粒的烧杯中充分反应。加入过量稀硫酸,用表面皿盖住烧杯并加热10分钟。冷却后用(2)中稀释后的KMnO4溶液滴定,消耗KMnO4溶液V2mL。
①锌粒的作用是___________。
②河水中Fe3+的浓度是___________mol/L(用含字母的代数式表示)。
Ⅱ:氢氧化亚铁[Fe(OH)2]在常温常压下为白色固体。
(4)当溶液中的离子浓度<1×10-5mol·L-1时,可以认为该离子已沉淀完全。已知常温Fe(OH)2的Ksp为8.0×10-16。现调节含Fe2+的某河水样品pH=9,用简要计算过程说明Fe2+是否已经达到沉淀完全:___________。
(5)一种用Na2SO4溶液做电解液,电解制取Fe(OH)2的实验装置如图所示。通电后,溶液中产生白色沉淀,且较长时间不变色。

①必须使用铁电极的是___________(填“A"或“B”)极。
②B电极的电极反应式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某抗肿瘤药物中间体的合成路线如下。下列说法正确的是( )
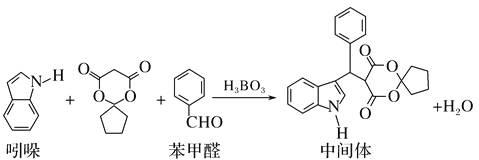
A. 吲哚的分子式为C8H6N
B. 苯甲醛中所有原子不可能全部共平面
C. 可用新制氢氧化铜悬浊液区分苯甲醛和中间体
D. 1mol该中间体,最多可以与9mol氢气发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢叠氨酸(HN3)及其盐(NaN3、NH4N3、CuN3等) 都具有爆炸性,最近南京理工大学胡丙成教授团队成功合成出PHAC,其化学式为(N3)3 (NH4)4Cl。回答问题:
(1) PHAC中“N3”的化合价为_____________,N2F2的电子式为_____________。
(2)汽车安全气囊中NaN3可发生下列反应:
NaN3(s)=Na(s)+![]() N2(g) △H1
N2(g) △H1
2NaN3(s)+CuO(s)=Na2O(s)+3N2(g)+Cu(s) △H2
则反应CuO(s)+2Na(s)= Na2O(s)+ Cu(s) △H=_______(用△H1和△H2表示)
(3) 25℃,将1molNH4N3(s)投入一2L的恒容密闭容器中,0.5min后反应达到平衡,测得生成的两种单质的物质的量之和为1.6mol,则NH4N3的平衡转化率为________,25℃时该反应的平衡常数K=__________。
(4) 氢叠氨酸(HN3)易溶于水,且酸性与醋酸相近。
① HN3在水溶液中的电离方程式为_____________。
② 0.1mol·L-1的HN3溶液与0.1mol·L-1的NaN3等体积混合,混合溶液中各离子浓度有大到小的顺序为_________________。
③ 已知T℃时,Ksp(CuN3)=5.0×10-9,Ksp(Cu2S)=2.5×10-48,则相同温度下反应:
Cu2S(s)+2N3-(aq) ![]() 2CuN3(s)+S2-(aq)的平衡常数K=_______________。
2CuN3(s)+S2-(aq)的平衡常数K=_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】东白山松树和金背松鼠体内细胞的某些元素含量(占细胞干重(除去水)的质量百分数)如表 所示,下列有关叙述正确的是( )

A.依据 N、S 含量可推知,金背松鼠细胞内最多的化合物是蛋白质
B.东白山松树的含水量比金背松鼠多
C.测定该动物的某种小分子含 C、H、O、N、S,此小分子是氨基酸
D.这两种生物体内所含的化学元素的种类和含量差异均很大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究化学反应时,既要考虑物质变化与能量变化,又要关注反应的快慢与限度。回答下列问题:
(1)NH3还原NO是重要的烟气脱硝技术,其反应过程与能量关系如图所示

①上图中因为改变了反应条件,反应的活化能:b_______(填“>”“<"或“=”)a。
②脱硝反应的热化学方程式可表示为反应物→生成物△H=______(用E1、E2的代数式表示)。
③研究发现,一定条件下的脱硝反应过程可能如图所示,根据氧化还原反应中物质的作用,NO为_______剂,脱硝总反应的化学方程式为_______________。

(2)一定温度下,将不同物质的量的H2O(g)和CO分别通入容积为1L的恒容密容器中,进行反应H2O(g)+CO(g)![]() CO2(g)+H2(g),得到如表所示的三组数据
CO2(g)+H2(g),得到如表所示的三组数据
试验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡时间/min | ||
H2O(g) | CO(g) | CO(g) | H2(g) | |||
1 | 650 | 2.0 | 4.0 | 3.0 | 1.0 | 5 |
2 | 900 | 1.0 | 2.0 | 1.8 | 0.2 | 4 |
3 | 900 | a | b | c | d | t |
①4mim内,实验2中v(CO2)=______; 900℃时,反应的平衡常数为______;降低温度时,平衡常数会________(填“增大”“减小”或“不变”)。
②650℃时,若在此容器中充入2.0 mol H2O(g)、1.0molCO(g)、1.0 mol CO2(g)和 xmol H2(g),要使反应在开始时向正反应方向进行,则x应满足的条件是__________。
若a=2.0.b=1.0,则平衡时实验2中H2O(g)和实验3中CO(g)的转化率(a)的关系为a(H2O) _______ (填“>”<”成=”)a(CO)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按图装置实验,若x轴表示流入正极的电子的物质的量,则y轴应表示( )
①c(Ag+) ②c(NO3-) ③a棒的质量 ④b棒的质量 ⑤溶液的质量
A. ① ③ B. ③ ④ C. ① ② ④ D. ②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合物H ( )是一种聚酰胺纤维,广泛用于各种刹车片,其合成路线如下:
)是一种聚酰胺纤维,广泛用于各种刹车片,其合成路线如下:

已知:①C、D、G均为芳香族化合物,分子中均只含两种不同化学环境的氢原子。
②Diels-Alder反应:![]() 。
。
(1)生成A的反应类型是_______。D的名称是_______。F中所含官能团的名称是_______。
(2)B的结构简式是_______;“B→C”的反应中,除C外,另外一种产物是_______。
(3)D+G→H的化学方程式是______。
(4)Q是D的同系物,相对分子质量比D大14,则Q可能的结构有______种,其中核磁共振氢谱有4组峰,且峰面积比为1:2:2:3的结构简式为______(任写一种)。
(5)已知:乙炔与1,3-丁二烯也能发生Diels-Alder反应。请以1,3-丁二烯和乙炔为原料,选用必要的无机试剂合成 ,写出合成路线__________(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
,写出合成路线__________(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用浓盐酸、二氧化锰共热制氯气,并用制得的氯气和氢氧化钙制取少量漂粉精。现已知反应:2Cl2+2Ca(OH)2=Ca(ClO)2+CaCl2+2H2O是放热反应。温度稍高会发生副反应:6Cl2+6Ca(OH)2=Ca(ClO3)2+5CaCl2+6H2O。
现有3个同学分别设计的3套实验装置如图:

(1)C装置中发生反应的化学方程式为:___,E装置中发生反应的化学方程式为:___。
(2)请从以下几个方面对甲乙丙3套实验装置的优缺点作出评价,并将符合题目要求的选项的序号填在表中空格中。___
a.不容易控制反应速率 b.容易控制反应速率
c.有副反应发生 d.可防止副反应发生
e.污染环境 f.可防止污染环境
优点 | 缺点 | |
甲装置 | ||
乙装置 | ||
丙装置 |
(3)上述装置中甲由A、B两部分组成,乙由C、D、E三部分组成,丙由F、G两部分组成,请从上述装置中选取合理的部分,组装一套较完整的实验装置,装置各部分的连接顺序是___(按气流流动的方向)。该组合中还缺少的装置是___(用文字说明),需要该装置的原因是___。
(4)实验室若用16mol/L的盐酸100mL与足量的二氧化锰反应,理论上最终生成的次氯酸钙的物质的量最多不超过___mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com