
【题目】(1)下列数量的各物质所含原子数按由大到小的顺序排列的是____。
①0.5 mol氨气 ②标准状况下22.4 L氦气 ③4℃时9 mL水 ④0.2 mol磷酸钠
(2)某双原子分子构成的气体,其摩尔质量为Mg/mol,该气体质量为mg,阿伏加德罗常数为NA,则:
①该气体的物质的量为____mol
②该气体在标准状况下的体积为____L
③该气体在标准状况下的密度为____g/L
④该气体所含原子总数为____个
⑤该气体的一个分子的质量为____g。
【答案】①④③② ![]()
![]()
![]()
![]()
![]()
【解析】
(1)①0.5mol氨气含有原子物质的量=0.5mol×4=2mol;
②标准状况下22.4L氦气的物质的量为1mol,为单原子分子,含有原子为1mol;
③4℃时9mL水的质量为9g,其物质的量=![]() =0.5mol,含有原子物质的量=0.5mol×3=1.5mol;
=0.5mol,含有原子物质的量=0.5mol×3=1.5mol;
④0.2mol磷酸含有原子物质的量=0.2mol×8=1.6mol,
故含有原子数目①>④>③>②;
(2)该气体的物质的量为:n=![]() =
=![]() mol;
mol;
该气体在标准状况下的体积为:V=22.4L/mol×=![]() mol=
mol=![]() L;
L;
该气体在标准状况下的密度为:ρ=![]() =
=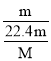 =
=![]() g/L;
g/L;
该气体所含原子总数为:N=n(原子)NA=![]() mol×2×NA=
mol×2×NA=![]() ;
;
该气体含有的分子个数为:![]() mol×NA=
mol×NA=![]() ,一个气体分子的质量为:
,一个气体分子的质量为:![]() =
=![]() g。
g。


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
【题目】我国对可呼吸的钠——二氧化碳电池的研究取得突破性进展,该电池的总反应式为:4Na+3CO2![]() 2Na2CO3+C,其工作原理如图所示(放电时产生的碳酸钠固体储存于碳纳米管中)。关于该电池,下列说法错误的是
2Na2CO3+C,其工作原理如图所示(放电时产生的碳酸钠固体储存于碳纳米管中)。关于该电池,下列说法错误的是

A. 放电时,当转移1 mol电子时负极质量减轻23 g
B. 充电时,Na+从阳极向阴极移动
C. 放电时,正极反应式为3CO2+4Na++4e-=2Na2CO3+C
D. 可以用乙醇代替TEGDME作有机溶剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,4-环己二醇可用于生产聚酯纤维,可通过下列路线合成(某些反应的反应物和反应条件未列出):

(1)写出反应①、⑦的化学方程式:
①____________________________________________________________________________;
⑦____________________________________________________________________________。
(2)上述七个反应中属于消去反应的有____________(填反应序号)。
(3)反应⑤中可能产生一定量的副产物,其可能的结构简式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,m g气体A与n g气体B的分子数相同,下列说法中不正确的是
A. 两种气体A与B的相对分子质量之比为m∶n
B. 同质量气体A与B的分子数之比为n∶m
C. 同温同压下,A、B两气体的密度之比为n∶m
D. 相同状况下,同体积A、B两气体的质量之比为m∶n
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将NaOH溶液分别滴加到两种一元弱酸HA和HB中,两种混合溶液的pH与离子浓度变化的关系如图所示。下列叙述正确的是

A. Ka(HA)的数量级为10-5
B. 当NaOH溶液与HB混合至中性时:c(B-)<c(HB)
C. 等浓度的NaA、NaB溶液中,水的电离程度:NaA<NaB
D. 等浓度的HB和NaA的混合溶液中:c(Na+)>c(A-)>c(B-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用Na2FeO4溶液氧化废水中的还原性污染物M,为研究降解效果,设计如下对比实验探究温度、浓度、 pH、催化剂对降解速率和效果的影响,实验测得M的浓度与时间关系如图所示:

下列说法正确的是
A. 实验①在15 min内M的降解速率为1.33×10-2mol/(L·min)
B. 若其他条件相同,实验①②说明升高温度,M降解速率增大
C. 若其他条件相同,实验①③证明pH越高,越有利于M的降解
D. 实验②④说明M的浓度越小,降解的速率越慢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下。

下列说法不正确的是
A. 生成CH3COOH总反应的原子利用率为100%
B. CH4→CH3COOH过程中,有C―H键发生断裂
C. ①→②放出能量并形成了C―C键
D. 该催化剂可有效提高反应物的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 25℃时,pH=1的盐酸溶液中,由水电离出的H+个数为10-13NA
B. 在反应KIO3+6HI=KI+3I2+3H2O中,每生成3molI2转移的电子数为6NA
C. 1L0.1molL-1NaHCO3溶液中含有0.1NA个HCO3-
D. 100gCaCO3与KHCO3的混合物中含有的阴离子的数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷是一种重要的化工原料和清洁能源,研究其再生及合理利用有重要意义。
请回答:
(1)已知一定条件下发生如下反应:
CO2(g)+2H2O(g)![]() CH4(g)+2O2(g) △H=+802kJ·mol-1。
CH4(g)+2O2(g) △H=+802kJ·mol-1。
将一定量的CO2(g)和H2O(g)充入10L密闭容器中,分别在催化剂M、N的作用下发生上述反应,CH4(g)的产量(n)与光照时间(t)和温度(T)变化的关系如图1所示。
①若甲烷的燃烧热(△H)为-890kJ·mol-1,则水的汽化热△H=___________。(汽化热指1mol液体转化为气体时吸收的热量)
②T1℃、催化剂M作用下,0~20h内该反应速率v(H2O)=___________。

③根据图1判断,T1___________T2(填“>”“<”或“=”),理由为___________。
催化剂的催化效果:M___________N(填“强于”或“弱于”)。
(2)甲烷可用于制备合成气:CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H。将CH4(g)和H2O(g)以物质的量之比为1:3充入盛有催化剂的刚性容器中发生该反应。相同时间段内测得CO的体积分数(
CO(g)+3H2(g) △H。将CH4(g)和H2O(g)以物质的量之比为1:3充入盛有催化剂的刚性容器中发生该反应。相同时间段内测得CO的体积分数(![]() )与温度(T)的关系如图2所示。
)与温度(T)的关系如图2所示。
①T0℃时,CO的体积分数最大的原因为_________________________________。
②若T0℃时,容器内起始压强为p0,CO的平衡体积分数为10%,则反应的平衡常数Kp=___________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com