
【题目】将一定质量的镁和铝混合物投入200 mL稀硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入的NaOH溶液体积的变化关系如图所示。则下列说法不正确的是

A.镁和铝的总质量为9 g
B.最初20 mL NaOH溶液用于中和过量的稀硫酸
C.氢氧化钠溶液的物质的量浓度为5 mol·L-1
D.生成的氢气在标准状况下的体积为11.2 L
【答案】D
【解析】
试题分析:从图象中看到,从开始至加入NaOH溶液20mL,没有沉淀生成,说明原溶液中硫酸溶解Mg、Al后有剩余,此时发生的反应为:H2so4+2NaOH=Na2so4+2H2O.当V(NaOH溶液)=200mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3;
A、当V(NaOH溶液)=240mL时,沉淀不再减少,此时全部为Mg(OH)2 ,n(Mg)=n[Mg(OH)2 ]=0.15mol,
m(Mg)=0.15mol×24gmol-1=3.6g,n(Al)=n[Al(OH)3 ]=0.35mol-0.15mol=0.2mol,m(Al)=0.2mol×27gmol-1=5.4g,所以镁和铝的总质量为9g,A项正确,B项正确。C.从200mL到240mL,NaOH溶解Al(OH)3 :NaOH+Al(OH)3 =NaAlO2 +2H2O,则此过程消耗n(NaOH)=n[Al(OH)3 ]=0.2mol,c(NaOH)=0.2mol÷0.04 L=5molL-1,C项正确;D、由Mg+H2so4=Mgso4+H2↑,2Al+3H2so4=2Al2(so4)3+3H2↑可以计算出生成n(H2)=0.45mol,标准状况下V(H2)=0.45mol×22.4Lmol-1=10.08L,D项错误。答案选D。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D是四种短周期元素,E是过渡元素,A、B、C同周期,C、D 同主族,A原子M层电子数是L层的一半,B是同周期第一电离能最小的元素,C在同周期中未成对电子数最多,E的外围电子排布式为3d64s2。回答下列问题:
(1)写出下列元素的名称:A_____,B_____, C_____, D______。
(2)上述五种元素中最高价氧化物对应水化物酸性最强的是(用化学式表示,下同)_________,碱性最强的是________。
(3)D所在周期第一电离能最小的元素是_____,电负性最大的元素是_____。(填元素符号)
(4)D的氢化物比C的氢化物的沸点_____(填“高”或“低”),原因是_____________________。
(5)E元素原子的核电荷数是_____,E元素在周期表的位置是_______________, E元素处于周期表分区中的______区。
(6)A、C最高价氧化物的晶体类型是分别是:_______晶体、_______晶体。
(7)画出D的核外电子排布图_____________________,D的原子结构示意图_________。
(8)用电子式表示B的硫化物的形成过程:______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有一澄清溶液,只可能含有下表中的若干种离子(存在的离子均大量):
阳离子 | K+、NH4+、H+、Ba2+ |
阴离子 | Cl-、CO32-、SO42-、OH- |
现取三份上述澄清溶液各100 mL,分别进行以下实验:
①第一份加入AgNO3溶液有沉淀产生;
②第二份加入足量NaOH溶液加热后,收集到气体0.04 mol;
③第三份加入足量BaCl2溶液后,得干燥沉淀6.27 g,经足量盐酸洗涤,干燥后,沉淀质量为2.33 g。
请回答下列问题:
(1)100 mL溶液中c(SO42-)=________________。
(2)第二份加入NaOH溶液产生气体的离子方程式___________________________。
(3)6.27 g沉淀的成分是______________ (用化学式表示)。
(4)上述澄清溶液中除SO42-以外,一定大量存在的离子是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中,溶质的物质的量浓度为1moI/L的是
A. 将6.2gNa2O溶解于水,并配成200mL溶液
B. 1L含1mol K+的K2SO4溶液
C. 将22.4LHC1溶于1L水
D. 将40.0 g NaOH溶于1L水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产硫酸过程中,SO2在接触室中被催化氧化为SO3气体,已知该反应为放热反应。现将2 mol SO2、1 mol O2充入一密闭容器充分反应后,放出热量98.3 kJ,此时测得SO2的转化率为50%,则下列热化学方程式正确的是
A.2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196.6 kJ·mol-1
2SO3(g) ΔH=-196.6 kJ·mol-1
B.2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-98.3 kJ·mol-1
2SO3(g) ΔH=-98.3 kJ·mol-1
C.SO2(g)+![]() O2(g)
O2(g)![]() SO3(g) ΔH=+98.3 kJ·mol-1
SO3(g) ΔH=+98.3 kJ·mol-1
D.SO2(g)+![]() O2(g)
O2(g)![]() SO3(g) ΔH=-196.6 kJ·mol-1
SO3(g) ΔH=-196.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关性质的比较,不正确的是( )
A. 酸性强弱:HI>HBr>HCl
B. 非金属性:O>S>Se
C. 还原性强弱:F->Cl->I-
D. 碱性强弱:KOH>NaOH>LiOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3是一种重要的化工原料,可以制备一系列物质(见图)。下列说法正确的是
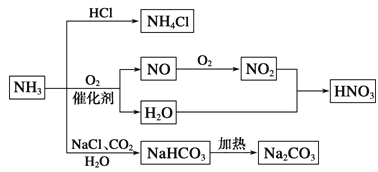
A.NH4Cl和NaHCO3都是常用的化肥
B.NH4Cl、HNO3和Na2CO3受热时都易分解
C.NH3和NO2在一定条件下可发生氧化还原反应
D.图中所涉及的反应均为氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温常压下,某生物燃料电池(BFC)以乙醇为燃料,直接或间接利用酶作催化剂,其总反应为C2H5OH+302![]() 2C02+3H20,其工作原理如图所示。下列有关说法正确的是( )
2C02+3H20,其工作原理如图所示。下列有关说法正确的是( )

A. 乙醇发生还原反应
B. b极上的电极反应式为O2+4e-+H2O=4OH-
C. 电池工作时,电解液中的H+由a极向b极迁移
D. 当外电路中有1.2 mol电子转移时,能产生4.48 L CO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com