
【题目】下列有关性质的比较,不正确的是( )
A. 酸性强弱:HI>HBr>HCl
B. 非金属性:O>S>Se
C. 还原性强弱:F->Cl->I-
D. 碱性强弱:KOH>NaOH>LiOH
科目:高中化学 来源: 题型:
【题目】草酸钴是制作氧化钴和金属钴的原料。一种利用含钴废料(主要成分为Co2O3,含少量Fe2O3、Al2O3、CaO、MgO、碳及有机物等)制取CoC2O4的工艺流程如下::

(1)“550℃焙烧”的目的是______________________;
(2)“浸出液”的主要成分是_____________________;
(3)“钴浸出”过程中Co3+转化为Co2+,反应的离子方程式为_____________________;
(4)“净化除杂1”过程中,先在40 ~ 50℃加入H2O2,其作用是___________________________(用离子方程式表示);再升温至80 ~ 85℃,加入Na2CO3溶液,调pH至4.5,“滤渣1”主要成分的是
_____________________。
(5)“净化除杂2”可将钙、镁离子转化为沉淀过滤除去,若所得滤液中c(Ca2+)=1.0×l0-5mol /L,则滤液中 c(Mg2+)为________________ [已知Ksp(MgF2) =7.35×10-11、Ksp(CaF2) =1.05×10-10]。
(6)为测定制得样品的纯度,现称取1.00 g样品,将其用适当试剂转化,得到草酸铵[(NH4)2C2O4]溶液,再用过量稀硫酸酸化,用0. 1000 mol/L KMnO4溶液滴定,达到滴定终点时,共用去KMnO4溶液26.00 mL,则草酸钴样品的纯度为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种重要化工原料,又是一种可再生能源,具有开发和应用的广阔前景。
(1)已知:CH3OH(g) ===HCHO(g)+H2(g) ΔH=+84 kJ·mol-1
2H2(g)+O2(g) ===2H2O(g) ΔH=-484 kJ·mol-1
工业上常以甲醇为原料制取甲醛,请写出CH3OH(g)与O2(g)反应生成HCHO(g)和H2O(g)的热化学方程式:__________________________。
(2)工业上可用如下方法合成甲醇,化学方程式为CO(g)+2H2(g)![]() CH3OH(g),已知某些化学键的键能数据如下表:
CH3OH(g),已知某些化学键的键能数据如下表:
化学键 | C—C | C—H | H—H | C—O | C≡O | O—H |
键能/ kJ·mol-1 | 348 | 413 | 436 | 358 | x | 463 |
请回答下列问题:
①该反应的ΔS____(填“>”或“<”)0。右图中曲线a到曲线b的措施是_____________________________。

②已知CO中的C与O之间为三键,其键能为x kJ·mol-1,则x=____。
(3)由甲醇、氧气和NaOH溶液构成的新型手机电池,可使手机连续使用一个月才充一次电。
①该电池负极的电极反应式为__________________。
②若以该电池为电源,用石墨作电极电解200 mL含有如下离子的溶液。
离子 | Cu2+ | H+ | Cl | SO42 - |
c/mol·L-1 | 0.5 | 2 | 2 | 0.5 |
电解一段时间后,当两极收集到相同体积(相同条件下)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象)阳极上收集到氧气的质量为____。

(4)电解水蒸气和CO2产生合成气(H2+CO)。较高温度下(700~1 000 ℃),在SOEC两侧电极上施加一定的直流电压,H2O和CO2在氢电极发生还原反应产生O2,O2穿过致密的固体氧化物电解质层到达氧电极,在氧电极发生氧化反应得到纯O2。由上图可知A为直流电源的____(填“正极”或“负极”),请写出以H2O为原料生成H2的电极反应式:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列能说明氯原子得电子能力比硫原子强的是
①HC1的溶解度比H2S大
②HC1的酸性比H2S强
③HCl的稳定性比H2S强
④HC1的还原性比H2S强
⑤HC1O的酸性比H2SO4强
A. ①②⑤ B. ③④ C. ③ D. ①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的镁和铝混合物投入200 mL稀硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入的NaOH溶液体积的变化关系如图所示。则下列说法不正确的是

A.镁和铝的总质量为9 g
B.最初20 mL NaOH溶液用于中和过量的稀硫酸
C.氢氧化钠溶液的物质的量浓度为5 mol·L-1
D.生成的氢气在标准状况下的体积为11.2 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸氯(C1NO)是有机合成中的重要试剂。可由NO与Cl2在通常条件下反应得到,化学方程式为2NO(g)+C12(g)![]() 2C1NO(g)。
2C1NO(g)。
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酸氯,涉及如下反应:
①2NO2(g)+NaC1(s)![]() NaNO3(s)+ClNO(g) K1
NaNO3(s)+ClNO(g) K1
②4NO2(g)+2NaC1(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g) K2
2NaNO3(s)+2NO(g)+Cl2(g) K2
③2NO(g)+C12(g)![]() 2C1NO(g) K3
2C1NO(g) K3
则K1,K2,K3之间的关系为K3=______________。
(2)已知几种化学键的键能数据如下表(亚硝酸氯的结构为Cl-N=O):

则2NO(g)+C12(g)![]() 2C1NO(g)反应的ΔH和a的关系为ΔH =_____________kJ/mol。
2C1NO(g)反应的ΔH和a的关系为ΔH =_____________kJ/mol。
(3)300℃时,2NO(g)+C12(g)![]() 2ClNO(g)的正反应速率表达式为v正 = k·cn(ClNO),测得速率和浓度的关系如下表:
2ClNO(g)的正反应速率表达式为v正 = k·cn(ClNO),测得速率和浓度的关系如下表:
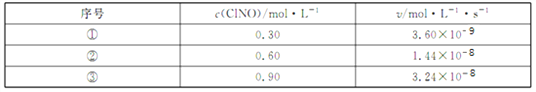
n =____________;k =__________________(注明单位)。
(4)在1L的恒容密闭容器中充入2molNO(g)和1molC12(g),在不同温度下测得c(C1NO)与时间的关系如图A:

①该反应的ΔH ____________0(填“>”、“<”或“=”);
②反应开始到10min时NO的平均反应速率v(NO)=____________mol/(L·min);
③T2时该反应的平衡常数K=____________。
(5)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数随n(NO)/n(C12)的变化图象如图B,则A、B、C三状态中,NO的转化率最大的是____________点,当n(NO)/n(C12)=1.5时,达到平衡状态ClNO的体积分数可能是D、E、F三点中的____________点。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物与生产生活关系密切。请完成下列填空:
(1)肼由N、H两种元素组成,它常用作火箭推进剂。肼的相对分子质量为32,分子中N、H原子的个数比为1:2。肼的分子式为_________。1mol的肼分子中含有的电子总数为_____NA(NA为阿伏伽德罗常数的值)。16g肼分子中所含的氮原子数与标准状况下____L N2中所含的氮原子数相等。
(2)在相同温度和压强下,体积相同的两个容器中分别盛有N2和O2。下列说法不正确的是____(填序号)。
A.N2和O2的密度之比为7:8 B.两容器内的气体具有相同的分子数
C.两容器内的气体具有相同的原子数 D.两容器内的气体具有相同的质子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.1 mol L-1的Na0H溶液分别滴定体积均为20mL、浓度均为0.1 mol L-1的HCl溶液和HX溶液,溶液的pH随加入 Na0H溶液体积的变化如图所示。下列说法正确的是( )

A. M点对应溶液中:c(HX)<C(X-)
B. HX的电离平衡常数Ka约为1×10-5
C. P 点对应溶液中 c(Cl-) = 0.05 mol L-1
D. N点对应溶液pH>7的原因是X-+H20![]() HX+0H-
HX+0H-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com