
【题目】草酸钴是制作氧化钴和金属钴的原料。一种利用含钴废料(主要成分为Co2O3,含少量Fe2O3、Al2O3、CaO、MgO、碳及有机物等)制取CoC2O4的工艺流程如下::

(1)“550℃焙烧”的目的是______________________;
(2)“浸出液”的主要成分是_____________________;
(3)“钴浸出”过程中Co3+转化为Co2+,反应的离子方程式为_____________________;
(4)“净化除杂1”过程中,先在40 ~ 50℃加入H2O2,其作用是___________________________(用离子方程式表示);再升温至80 ~ 85℃,加入Na2CO3溶液,调pH至4.5,“滤渣1”主要成分的是
_____________________。
(5)“净化除杂2”可将钙、镁离子转化为沉淀过滤除去,若所得滤液中c(Ca2+)=1.0×l0-5mol /L,则滤液中 c(Mg2+)为________________ [已知Ksp(MgF2) =7.35×10-11、Ksp(CaF2) =1.05×10-10]。
(6)为测定制得样品的纯度,现称取1.00 g样品,将其用适当试剂转化,得到草酸铵[(NH4)2C2O4]溶液,再用过量稀硫酸酸化,用0. 1000 mol/L KMnO4溶液滴定,达到滴定终点时,共用去KMnO4溶液26.00 mL,则草酸钴样品的纯度为__________________。
【答案】 除去碳和有机物 NaAlO2(答“NaAlO2和NaOH”也可得分) 2Co3++SO32-+H2O=2Co2++SO42-+2H+ 2Fe2++2H++H2O2=2Fe3++2H2O Fe(OH) 3 7.0×10-6mol/L(不带单位扣一分) 95.55%
【解析】(1)含钴废料中的碳及有机物在550℃焙烧时可以生成二氧化碳等被除去,故答案为:除去碳和有机物;
(2)含钴废料中的Al2O3能够被氢氧化钠溶解,因此浸出液中主要含有偏铝酸钠,故答案为:NaAlO2;
(3)“钴浸出”过程中Co3+可以被亚硫酸钠还原为Co2+,反应的离子方程式为2Co3++SO32-+H2O=2Co2++SO42-+2H+,故答案为:2Co3++SO32-+H2O=2Co2++SO42-+2H+;
(4)在钴浸出过程中铁离子被亚硫酸钠含有为亚铁离子,在“净化除杂1”过程中,先在40 ~ 50℃加入H2O2,可以将亚铁离子氧化为铁离子,离子方程式为2Fe2++2H++H2O2=2Fe3++2H2O ;再升温至80 ~ 85℃,加入Na2CO3溶液,调pH至4.5,式铁离子沉淀为氢氧化铁,故答案为:2Fe2++2H++H2O2=2Fe3++2H2O;Fe(OH) 3;
(5)根据Ksp(CaF2) =1.05×10-10,若所得滤液中c(Ca2+)=1.0×l0-5mol /L,则c(F-)= =
=![]() mol /L,则c(Mg2+)=
mol /L,则c(Mg2+)= =
=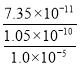 =7.0×10-6mol/L,故答案为:7.0×10-6mol/L;
=7.0×10-6mol/L,故答案为:7.0×10-6mol/L;
(6)设草酸钴的质量为x,根据方程式:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O,草酸根守恒可得:
5CoC2O4~5(NH4)2C2O4~5H2C2O4~2MnO4-
5×147g 2mol
x 0.026L×0.1000mol/L
![]() =
=![]() ,解得x=0.9555g,样品纯度=
,解得x=0.9555g,样品纯度=![]() ×100%= 95.55%,故答案为:95.55%。
×100%= 95.55%,故答案为:95.55%。


科目:高中化学 来源: 题型:
【题目】在标准状况下,将5.6g铁和4.6g钠分别与100m L 1mol/L的盐酸反应 ,则放出H2的体积( )
A. 铁的多 B. 钠的多 C. 铁和钠放出一样多 D. 无法比较
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、SO2等气体,严重污染空气。对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
Ⅰ.脱硝:
已知:H2的燃烧热为285.8 kJ·mol-1
N2(g)+2O2(g) =2NO2(g) ΔH = +133 kJ·mol-1
H2O(g) = H2O(l) ΔH =-44 kJ·mol-1
催化剂存在下,H2还原NO2生成水蒸气和其他无毒物质的热化学方程式为:__________________________。
Ⅱ.脱碳:
(1)向2L密闭容器中加入2molCO2和6molH2,在适当的催化剂作用下,发生反应:CO2(g)+3H2(g)![]() CH3OH(l)+H2O(l)
CH3OH(l)+H2O(l)
①该反应自发进行的条件是_____________(填“低温”、“高温”或“任意温度”)。
②下列叙述能说明此反应达到平衡状态的是____________。(填字母)
a.混合气体的平均摩尔质量保持不变 b.CO2和H2的体积分数保持不变
c.CO2和H2的转化率相等 d.混合气体的密度保持不变
e.1molCO2生成的同时有3mol H—H键断裂
③CO2的浓度随时间(0~t2)变化如下图所示,在t2时将容器容积缩小一倍,t3时达到平衡,t4时降低温度,t5时达到平衡,请画出t2~t6 CO2浓度随时间的变化。________________________

(2)改变温度,使反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH﹤0中的所有物质都为气态。起始温度、体积相同(T1℃、2L密闭容器)。反应过程中部分数据见下表:
CH3OH(g)+H2O(g) ΔH﹤0中的所有物质都为气态。起始温度、体积相同(T1℃、2L密闭容器)。反应过程中部分数据见下表:
反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) | |
反应Ⅰ:恒温恒容 | 0min | 2 | 6 | 0 | 0 |
10min | 4.5 | ||||
20min | 1 | ||||
30min | 1 | ||||
反应Ⅱ:绝热恒容 | 0min | 0 | 0 | 2 | 2 |
①达到平衡时,反应Ⅰ、Ⅱ对比:平衡常数K(I)______ K(II)(填“﹥”、“﹤”或“=”下同);平衡时CH3OH的浓度c(I)____ c(II)。
②对反应Ⅰ,前10min内的平均反应速率v(CH3OH) =______________ 。在其他条件不变的情况下,若30min时只改变温度T2℃,此时H2的物质的量为3.2mol,则T1___T2(填“>”、“<”或“=”)。若30min时只向容器中再充入1molCO2(g)和1molH2O(g),则平衡_____移动(填“正向”、“逆向”或“不”)。
(3)利用人工光合作用可将CO2转化为甲酸,反应原理为2CO2+2H2O=2HCOOH+O2,装置如图所示:

①电极2的电极反应式是____________;
②在标准状况下,当电极2室有11.2L CO2反应。 理论上电极1室液体质量_____(填“增加”或“减少”)______g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是四种短周期元素,E是过渡元素,A、B、C同周期,C、D 同主族,A原子M层电子数是L层的一半,B是同周期第一电离能最小的元素,C在同周期中未成对电子数最多,E的外围电子排布式为3d64s2。回答下列问题:
(1)写出下列元素的名称:A_____,B_____, C_____, D______。
(2)上述五种元素中最高价氧化物对应水化物酸性最强的是(用化学式表示,下同)_________,碱性最强的是________。
(3)D所在周期第一电离能最小的元素是_____,电负性最大的元素是_____。(填元素符号)
(4)D的氢化物比C的氢化物的沸点_____(填“高”或“低”),原因是_____________________。
(5)E元素原子的核电荷数是_____,E元素在周期表的位置是_______________, E元素处于周期表分区中的______区。
(6)A、C最高价氧化物的晶体类型是分别是:_______晶体、_______晶体。
(7)画出D的核外电子排布图_____________________,D的原子结构示意图_________。
(8)用电子式表示B的硫化物的形成过程:______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列说法正确的是
① 18g D2O含有的电子数为10NA;
② 1mol Na2O2与水完全反应时转移电子数为2NA ;
③ 12g石墨烯(单层石墨)中含有六元环的个数为0.5NA;
④ 在标准状况下,22.4LSO3的物质的量为1mol;
⑤ 7.8g过氧化钠中含有的离子数为0.3NA;
⑥ 28g 硅晶体中含有2NA个Si—Si键
⑦ 200mL1mol/LFe2(SO4)3溶液中,Fe3+和SO42-离子数的总和是NA
⑧ 在常温常压下,0.1mol铁与0.1molCl2充分反应,转移的电子数为0.3NA
⑨ 标准状况下,22.4LNO和11.2LO2混合后气体的分子总数为1.5NA
⑩ S2和S8的混合物共6.4g,其中所含硫原子数一定为0.2NA
A、①③⑤⑧ B、②④⑥⑦ C、③⑤⑥⑩ D、⑤⑧⑨⑩
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知部分弱酸的电离平衡常数如下表:
弱酸 | 醋酸 | 次氯酸 | 碳酸 | 亚硫酸 |
电离平衡常数(25℃) | Ka=1.75×10-5 | Ka=2.98×10-8 | Ka1=4.30×10-7 Ka2=5.61×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
下列离子方程式正确的是
A.少量CO2通入NaClO溶液中:CO2+H2O+2ClO-=CO![]() +2HClO
+2HClO
B.少量的SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO
C.少量的SO2通入Na2CO3溶液中:SO2+H2O+2 CO![]() =SO
=SO![]() +2HCO3-
+2HCO3-
D.相同浓度NaHCO3溶液与NaHSO3溶液等体积混合:H++HCO3-=CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关性质的比较,不正确的是( )
A. 酸性强弱:HI>HBr>HCl
B. 非金属性:O>S>Se
C. 还原性强弱:F->Cl->I-
D. 碱性强弱:KOH>NaOH>LiOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com