
【题目】下列离子方程式正确的是
A.溴化亚铁溶液中通少量的氯气:2Br-+ Cl2=== 2Cl-+ Br2
B.氢氧化铁悬浊液溶于氢碘酸溶液中:2Fe(OH)3+6H++2I- = 2Fe2++I2+6H2O
C.碳酸氢钙与少量的NaOH溶液反应:Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32-
D.稀硝酸与过量的铁屑反应:3Fe+8H++2NO3-=3Fe3++2NO↑+4H2O
 核心素养学练评系列答案
核心素养学练评系列答案科目:高中化学 来源: 题型:
【题目】2019年10月22日,位于资阳市境内的“安岳气田”天然气产量达到10.33亿立方米,历史性突破10亿立方米大关。“安岳气田”的开发,将惠及川渝地区天然气供给,促进地方经济社会的发展。对天然气的高效利用不仅能缓解大气变暖,而且对日益枯竭的石油资源也有一定的补充作用。
(1)已知甲烷临氧耦合CO2重整反应有:
反应I:2CH4(g)+O2(g)![]() 2CO(g)+4H2(g) △H=-71.4 kJ·mol-1
2CO(g)+4H2(g) △H=-71.4 kJ·mol-1
反应II:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) △H=+247.0 kJ·mol-1
2CO(g)+2H2(g) △H=+247.0 kJ·mol-1
已知断裂1 mol化学键所需的能量:
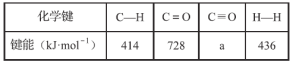
①a=_________。
②写出表示CO燃烧热的热化学方程式:____________________________________。
(2)在两个体积均为2L的恒容密闭容器中,起始时按表中相应的量加入物质,在温度为753K下进行(1)中反应II(不发生其它反应),CO2的平衡转化率如下表所示:
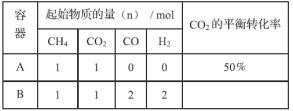
①若容器A中反应从开始到平衡所用的时间为t min,则t min内该反应的平均反应速率为:v(CO2)=_________(用含t的表达式表示)。
②温度为753K时该反应的平衡常数K=_________;容器B中的反应起始时将_________移动(填“正向”、“逆向”或“不”)。
③该反应达到平衡时,其他条件不变,若升高温度,此时v正_________ v逆(填“>”、“=”或“<”)。
④当容器A、B中的反应均达到平衡时,容器中n(CO)满足的关系:2n(CO)A______n(CO)B(填“>”、“=”或“<”)。
(3)将CH4(g)和O2(g)以物质的量比为4:3充入盛有催化剂的恒容密闭容器内,发生(1)中反应I,相同时间段内测得CO的体积分数[φ(CO)]与温度(T)的关系如图如示。
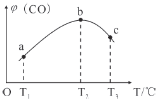
bc段CO的体积分数[φ(CO)]降低的主要原因是____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于如图所示转化关系(X代表卤素),下列说法正确的是( )

A.![]()
B.![]()
C.![]() 的非金属性依次减弱,所以途径II吸收的热量依次增多
的非金属性依次减弱,所以途径II吸收的热量依次增多
D.生成相同物质的量![]() 放出的热量比生成
放出的热量比生成![]() 的多,说明
的多,说明![]() 比
比![]() 稳定
稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列示意图与化学用语表述内容不相符的是(水合离子用相应离子符号表示)
A | B | C | D |
NaCl溶于水 |
电解CuCl2溶液 |
CH3COOH在水中电离 |
H2与Cl2反应能量变化 |
NaCl | CuCl2 | CH3COOH | H2(g)+Cl2(g) ΔH=183kJ·mol1 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.1000mol/L NaOH溶液滴定分别滴定0.1000mol/L的盐酸和醋酸溶液各25.00 mL。滴定过程中溶液pH随滴入的NaOH溶液体积变化的两条滴定曲线如图所示:
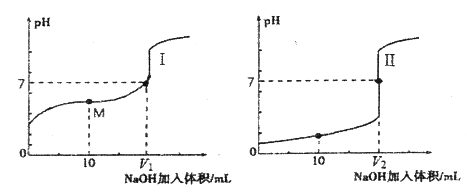
(1)滴定醋酸的曲线是_____________(填“Ⅰ”或“Ⅱ”)。
(2)下列方法中可使溶液中醋酸的电离程度减小的是_____________(填字母序号)。
A. 微热溶液 B. 加少量冰醋酸
C. 加少量醋酸钠固体 D. 加少量碳酸钠固体
(3)V1和V2的关系:V1________V2(填“>”、“=”或“<”)。
(4)M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由O2、NO2 和熔融NaNO3组成的燃料电池如图所示,在该电 池工作过程中石墨I电极产生一种气态氧化物Y。下列说法正确的是
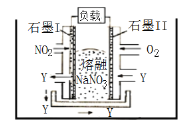
A.电子由负载流向石墨I
B.Y可能为NO
C.石墨I上发生还原反应
D.石墨II上的电极反应: O2 + 2N2O5 + 4e- = 4NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氯化钛是乙烯聚合催化剂的重要成分,制备反应如下:
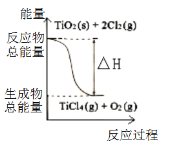
①TiO2 (s) + 2Cl2 (g) =TiCl4 (g)+O2 (g) ΔH 1 = +175.4 kJ·mol-1
②C(s) + 1/2O2 (g) = CO (g) ΔH 2 =-110.45 kJ·mol-1
下列说法正确的是
A.反应①中的能量变化如右图所示
B.若反应①中使用催化剂加快反应速率,单位时间内吸收更多热量,则ΔH 1变小
C.固体C的燃烧热是-110.45 kJ·mol-1
D.反应TiO2(s) + 2Cl2(g) + 2C(s) = TiCl4(g) + 2CO(g) ΔH =-45.5 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液X中可能含有下列离子中的若干种:NH4+、Na+、Ba2+、Fe3+、I-、SO32-、SO42-为了确定该溶液的组成,某同学取上述溶液X,进行了如下实验:
(1)向一定量溶液X加入少量氯水,然后滴加淀粉溶液,未显蓝色;
(2)另取100毫升溶液X再加入足量氯水,然后滴加足量BaCl2溶液,得到沉淀6.99g;
(3)将上述(2)的反应混合液过滤,在滤液中加足量NaOH溶液并加热,生成的气体在标准状况下体积为2.24L。
根据上述实验,以下推测正确的是
A.原溶液可能存在Na +、Fe3+、SO42-
B.原溶液一定存在NH4+、I-
C.原溶液一定不含Ba2+、Fe3+、I-
D.另取X试液滴加足量盐酸酸化的BaCl2溶液,即可确定溶液所有的离子组成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示。下列说法不正确的是( )
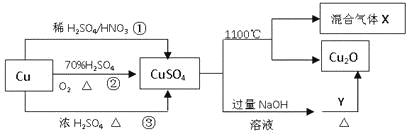
A.途径①所用混酸中H2SO4与HNO3物质的量之比最好为3:2
B.相对于途径①、③,途径②更好地体现了绿色化学思想
C.1molCuSO4在1100℃所得混合气体X中O2可能为0.75mol
D.Y可以是葡萄糖
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com