
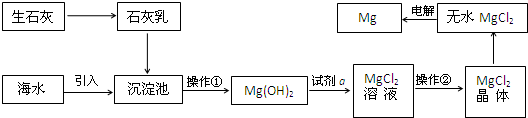
| ||
| ||


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:
| A、Na2SO4是钠盐、硫酸盐、正盐 |
| B、HNO3是一元酸、强酸、挥发性酸 |
| C、NaOH是一元碱、可溶性碱、强碱 |
| D、CO2是酸性氧化物、非金属氧化物、最高价氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
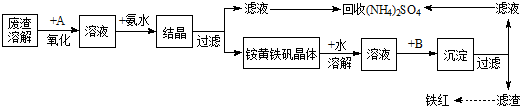
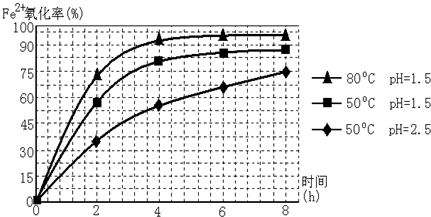
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
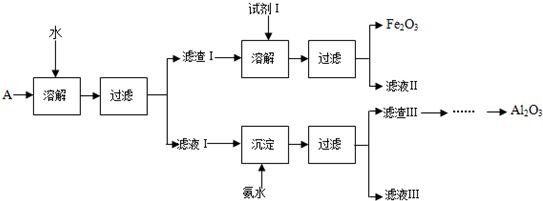
查看答案和解析>>
科目:高中化学 来源: 题型:
| W | X | |
| Y | Z |
| A、Z元素氧化物对应水化物的酸性一定强于Y |
| B、X、Y、Z中最简单氢化物稳定性最弱的是Y |
| C、X元素形成的单核阴离子还原性强于Y |
| D、Z元素单质在化学反应中只表现氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 3 |
| 4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com