
【题目】氮氧化物进入大气后,可能会形成硝酸型酸雨,因此必须对含有氮氧化物的废气进行处理.
(1)用NaOH可以吸收废气中的氮氧化物,反应的化学方程式如下:
2NO2+2NaOH═NaNO2+NaNO3+H2O 反应中,还原剂是 ,
NO2+NO+2NaOH═2NaNO2+H2O 反应中,氧化产物和还原产物之比为 .
(2)NO2和Br2蒸汽都是红棕色气体,下列可以用来鉴别这两种气体的试剂是 .
A.用氢氧化钠溶液
B.淀粉碘化钾溶液
C.用硝酸银溶液
D.用蒸馏水
(3)汽车尾气中含有一氧化氮和一氧化碳,消除这两种物质对大气污染的方法是安装催化转化器,使它们发生反应生成两种对大气无污染的气体,该反应的化学方程式为 .
(4)氨气也可用来处理氮氧化物,例如:氨气与二氧化氮反应生成氮气和水,写出该反应的化学方程式: , 若某工厂排出的废气中二氧化氮含量为0.5%(体积分数),处理1000m3(标准状况)这种废气,需要千克氨气.(结果保留两位小数)
【答案】
(1)NO2;1:1
(2)CD
(3)2NO+2CO ![]() N2+2CO2
N2+2CO2
(4)6NO2+8NH3 ![]() 7N2+12H2O;5.06
7N2+12H2O;5.06
【解析】解:(1)在反应①中,NO2→NaNO2 , N元素化合价降低1价,被还原,NO2→NaNO3 , N元素化合价升高1价,被氧化,氧化剂和还原剂是NO2 ,
在反应②中,NO2中N元素化合价降低,被还原,则NO2为氧化剂,NO中N元素化合价升高,被氧化,则NO为还原剂,则由化合价的升降可知氧化产物和还原产物的物质的量之比为1:1,所以答案是:NO2;1:1;(2)A.二氧化氮和氢氧化钠溶液反应气体颜色消失,溶液为无色溶液,溴单质和氢氧化钠溶液反应蒸气颜色消失,得到无色溶液,不可以鉴别二者,故A错误;
B.淀粉碘化钾溶液中碘离子具有还原性,二氧化氮和溴单质都具有强氧化性,碘离子可以被二氧化氮、溴蒸气氧化为碘单质,碘单质遇到淀粉变蓝色,不能检验二者,故B错误;
C.二氧化氮气体通入硝酸银溶液中,二氧化氮和水反应,反应后气体颜色消失,溶液为无色,溴蒸气通入硝酸银溶液中,溴单质好水反应生成HBr,HBr和硝酸银溶液反应生成淡黄色沉淀溴化银,可以鉴别二者,故C正确;
D.二氧化氮溶于水生成硝酸和一氧化氮,气体颜色消失,溴单质溶于水溶解溶液呈橙色,可以鉴别二者,故D正确;
所以答案是:C D;(3)NO和CO在催化作用下反应生成无毒气体,分别是二氧化碳和氮气,化学方程式为:2NO+2CO ![]() N2+2CO2 , 所以答案是:2NO+2CO
N2+2CO2 , 所以答案是:2NO+2CO ![]() N2+2CO2;(4)氨气和二氧化氮反应生成无污染的物质,则生成氮气与水,反应方程式为:6NO2+8NH3
N2+2CO2;(4)氨气和二氧化氮反应生成无污染的物质,则生成氮气与水,反应方程式为:6NO2+8NH3 ![]() 7N2+12H2O,发生反应为8NH3+6NO2═7N2+12H20,
7N2+12H2O,发生反应为8NH3+6NO2═7N2+12H20,
工厂排出的气体中二氧化氮为1×103m3×0.5%=5m3=5000L,
由8NH3+6NO2═7N2+12H20,可知需要氨气5000L× ![]() =6.67×103L,标准状况下物质的量n=
=6.67×103L,标准状况下物质的量n= ![]() =300mol,质量m=300mol×17g/mol=5062g=5.06Kg,
=300mol,质量m=300mol×17g/mol=5062g=5.06Kg,
所以答案是:6NO2+8NH3 ![]() 7N2+12H2O,5.06;
7N2+12H2O,5.06;


科目:高中化学 来源: 题型:
【题目】已知A、B、C、D之间的转化关系如图所示。下列说法正确的是( )

A. 若A为Fe,D为氢气,则B一定为酸
B. 若A、D为化合物,B为水,则C一定是气体单质
C. 若A、B、C、D均为化合物,该反应一定属于复分解反应
D. 若A、B、C、D均为10电子微粒,且C是可使湿润的红色石蕊试纸变蓝的气体,则D常温下一定呈液态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各装置图的叙述中,正确的是
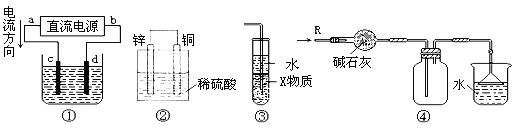
A. 若采用装置①铝件镀银,则c极为铝件,d极为纯银,电解质溶液为AgNO3溶液
B. 装置②是原电池,能将化学能转化为电能,SO42-移向锌电极
C. 装置③中X若为四氯化碳,用于吸收氨气或氯化氢,会引起倒吸
D. 装置④可用于收集氨气,并吸收多余的氨气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一些常见单质、化合物之间的转化关系图,有些反应中的部分物质被略去.常温常压下,A为无色有毒气体,B为红棕色粉末,C、E为金属单质,G、J的焰色均为黄色.反应①为炼铁高炉中的重要反应;反应②可用于焊接铁轨.
请回答下列问题:
(1)B的化学式为 , J的化学式为
(2)工业上将氯气通入石灰乳中制取漂白粉,该反应的化学反应方程式为
(3)D→G是侯氏制碱法的主要反应,该反应的化学方程式为 .
(4)K→H是制作印刷电路板的重要反应,该反应的离子方程式为 .
(5)F→L是铝土矿提纯中的重要反应,该反应的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a、b代表2种金属,下列叙述中,肯定能判断金属活动性a比b强的是( )
A. 常温下,a能从水中置换出氢,而b不能 B. 原子的电子层数a比b多
C. 原子的最外层电子数a比b少 D. 1 mol a 、b分别与足量盐酸反应,生成H2的质量a比b大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】周期表是一座开放的“元素大厦”,元素大厦尚未客满。请你在元素大厦中为119号元素安排好它的房间( )
A. 第八周期第IA族 B. 第七周期第ⅦA族
C. 第七周期第0族 D. 第六周期ⅡA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由乙烯和乙醇蒸气组成的混和气体中,若碳元素的质量百分含量为60%,则氧元素的质量百分含量为
A. 15.6% B. 26.7% C. 30% D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤燃烧产生的粉煤灰(主要含有SiO2、Fe2O3、Al2O3等)是火电厂产生的废渣,若不加处理会污染环境。为综合利用,研究人员对其进行如下处理:

(1)滤渣主要成分是________________;滤液①中的阳离子为_____________________。
(2)滤液①中还加入还原剂原因是________________;若加入的还原剂为铁粉,反应的离子方程式为_____________________________________。
(3)加入氨水是为了调节pH使铝离子沉淀,其离子方程式为_________________;反应终点的pH对铝和铁分离效果的影响如右图。根据实验结果,为达到好的分离效果,反应过程中控制pH的范围是__________,选择该范围的理由是_________。

(4)NH4HSO4和H2SO4按物质的量比1:1混合溶于水配制成浸取液,220℃时可将高铝粉煤灰中Al2O3转化为硫酸铝铵[NH4Al(SO4) 2],然后分离、煅烧获得纯Al2O3。
查阅资料知硫酸铝铵:①溶解度:0℃时,S=5.2g;100℃时,S=421.9g 。②280℃时分解。
①依据资料可知,将硫酸铝铵与其他溶质分离的方法是_____________。
②煅烧NH4Al(SO4)2时发生4NH4Al(SO4)2![]() 2Al2O3+5SO3↑+3SO2↑+2NH3↑+N2↑+5H2O↑,得到混合气体(NH3、N2、SO2、SO3、H2O)。若16mol混合气体按如下装置被完全吸收制得浸取液。则右下图中,试剂X是___________(填化学式);试剂Y是_________(填名称),其中溶质的物质的量为_____________。
2Al2O3+5SO3↑+3SO2↑+2NH3↑+N2↑+5H2O↑,得到混合气体(NH3、N2、SO2、SO3、H2O)。若16mol混合气体按如下装置被完全吸收制得浸取液。则右下图中,试剂X是___________(填化学式);试剂Y是_________(填名称),其中溶质的物质的量为_____________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com