
【题目】已知A、B、C、D之间的转化关系如图所示。下列说法正确的是( )

A. 若A为Fe,D为氢气,则B一定为酸
B. 若A、D为化合物,B为水,则C一定是气体单质
C. 若A、B、C、D均为化合物,该反应一定属于复分解反应
D. 若A、B、C、D均为10电子微粒,且C是可使湿润的红色石蕊试纸变蓝的气体,则D常温下一定呈液态
科目:高中化学 来源: 题型:
【题目】下列反应中,既属于氧化还原反应同时又属于吸热反应的是
A. Ba(OH)2·8H2O与NH4Cl反应 B. 铝与稀盐酸反应
C. 炽热的炭与CO2反应 D. 酸碱中和反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 生成物的总能量大于反应物的总能量时,△H<0
B. 在其他条件不变的情况下,使用催化剂可以改变反应方向
C. △H<0、△S>0的反应在低温时不能自发进行
D. 一个化学反应的△H只与反应体系的始态和终态有关,而与反应的途径无关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数w(Na2CO3),称取此混合物5.0g,溶于水中,配成250 mL溶液。
方案一:沉淀法。利用化学反应把HCO3-、CO32-完全转化为沉淀,称量干燥沉淀的质量,由此计算混合物中w(Na2CO3)。
(1)量取100 mL配制好的溶液于烧杯中,滴加足量沉淀剂,把溶液中HCO3-、CO32-完全转化为沉淀,应选用的试剂是________(填编号)。
A.CaCl2溶液 B.MgSO4溶液 C.NaCl溶液 D.Ba(OH)2溶液
(2)过滤,提取沉淀,则过滤操作所需要的玻璃仪器除烧杯和玻璃棒外,还有_______。
(3)将沉淀洗涤,并充分干燥,称量沉淀的质量为mg,由此可以计算(Na2CO3)。如果此步中,沉淀未干燥充分就称量,则测得w(Na2CO3)_______(填“偏大”、“偏小”或“无影响”)。

方案二:量气法。量取10.00 mL配制好的溶液与足量稀硫酸溶液反应,测定生成气体在通常状况(约20℃、1.01×105 Pa)的体积,由此计算混合物中w(Na2CO3)。
(1)装置中导管a的作用是______________________________, 若撤去导管a会使测得气体体积_______(填“偏大”、“偏小”或“无影响”)。
(2)反应结束后,为了准确地测量气体体积,量气管在读数时应注意:①___________________,②_________________________,③_______________________。
方案三:滴定法。量取25.00 mL配制好的溶液加入锥形瓶中,滴加2滴酚酞试剂,摇匀,用0.2000 mol/L的盐酸滴定到终点(已知终点时反应H++ CO32-![]() HCO3-恰好完全,此时溶液pH<8)。重复此操作2次,消耗盐酸的体积平均值为20.00 mL。量取25.00 mL配制好的溶液,应选择碱式滴定管来完成。请问
HCO3-恰好完全,此时溶液pH<8)。重复此操作2次,消耗盐酸的体积平均值为20.00 mL。量取25.00 mL配制好的溶液,应选择碱式滴定管来完成。请问
(1)判断滴定终点的依据是_________________________。
(2)此法测得w(Na2CO3)=___________%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,属于取代反应的是( )
A. 乙烯在空气中燃烧 B. 乙烯在一定条件下跟HCl反应
C. 苯与液溴在FeBr3催化下生成溴苯 D. 苯在一定条件下跟H2反应生成环己烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。
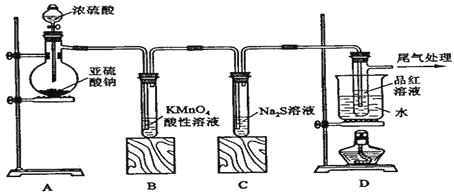
请到答F列问题:
(1)装置A中盛放亚硫酸钠的仪器名称是 ,其中发生反应的化学方程式为 ;
(2)实验过程中,装置B、C中发生的现象分别是 、 ,这些现象分别说明SO2具有的性质是 和 ;装置B中发生反应的离子方程式为 ;
(3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象 ;
(4)尾气可采用 溶液吸收。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化物进入大气后,可能会形成硝酸型酸雨,因此必须对含有氮氧化物的废气进行处理.
(1)用NaOH可以吸收废气中的氮氧化物,反应的化学方程式如下:
2NO2+2NaOH═NaNO2+NaNO3+H2O 反应中,还原剂是 ,
NO2+NO+2NaOH═2NaNO2+H2O 反应中,氧化产物和还原产物之比为 .
(2)NO2和Br2蒸汽都是红棕色气体,下列可以用来鉴别这两种气体的试剂是 .
A.用氢氧化钠溶液
B.淀粉碘化钾溶液
C.用硝酸银溶液
D.用蒸馏水
(3)汽车尾气中含有一氧化氮和一氧化碳,消除这两种物质对大气污染的方法是安装催化转化器,使它们发生反应生成两种对大气无污染的气体,该反应的化学方程式为 .
(4)氨气也可用来处理氮氧化物,例如:氨气与二氧化氮反应生成氮气和水,写出该反应的化学方程式: , 若某工厂排出的废气中二氧化氮含量为0.5%(体积分数),处理1000m3(标准状况)这种废气,需要千克氨气.(结果保留两位小数)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com