
【题目】如图所示,已知A元素的最低化合价为﹣3价,它的最高价氧化物含氧56.21%,原子核内中子数比质子数多1,试回答: 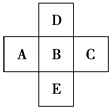
(1)写出它们的元素符号: A , B , C , D , E .
(2)A、B、C、D的气态氢化物稳定性最差的是 .
(3)A、B、C的原子半径由小到大的顺序是 .
(4)A、B、C三元素最高价氧化物对应水化物的酸性由强到弱的顺序是 .
【答案】
(1)P;S;Cl;O;Se
(2)PH3
(3)Cl<S<P
(4)HClO4>H2SO4>H3PO4
【解析】解:(1)A元素的最低化合价为﹣3价,则最高价为+5价,它的最高价氧化物为A2O5 , 含氧56.21%,设相对原子质量为x,则 ![]() ×100%=56.21%,解得x=31,故A为P元素,由元素在周期表中的位置可知,B为S,C为Cl,D为O,E为Se,所以答案是:P;S;Cl;O;Se;(2)A、B、C、D中P元素非金属性最差,故气态氢化物稳定性最差的是:PH3 , 所以答案是:PH3; (3)同周期自左而右原子半径减小,故原子半径:Cl<S<P,所以答案是:Cl<S<P;(4)同周期自左而右非金属性增强,最高价含氧酸酸性增强,故酸性:HClO4>H2SO4>H3PO4 , 所以答案是:HClO4>H2SO4>H3PO4 .
×100%=56.21%,解得x=31,故A为P元素,由元素在周期表中的位置可知,B为S,C为Cl,D为O,E为Se,所以答案是:P;S;Cl;O;Se;(2)A、B、C、D中P元素非金属性最差,故气态氢化物稳定性最差的是:PH3 , 所以答案是:PH3; (3)同周期自左而右原子半径减小,故原子半径:Cl<S<P,所以答案是:Cl<S<P;(4)同周期自左而右非金属性增强,最高价含氧酸酸性增强,故酸性:HClO4>H2SO4>H3PO4 , 所以答案是:HClO4>H2SO4>H3PO4 .


科目:高中化学 来源: 题型:
【题目】A、B、C、X是中学化学常见的物质,它们之间的转化关系如图所示(反应条件和部分产物省略).请回答下列问题: ![]()
(1)若A、B、C均为焰色反应呈黄色的化合物,X是一种常见的温室气体,向B的水溶液中滴加2滴酚酞,溶液呈色,A生成B的化学方程式为 .
(2)若B是一种两性不溶物,B生成C的离子方程式为 .
(3)若A是一种使湿润的红色石蕊试纸变蓝的气体,A转变为C是工业生产中的一种重要反应,该反应的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,改变反应物的用量或浓度,对生成物不会产生影响的是 ( )
A.FeBr2溶液和氯水反应
B.二氧化碳通人氢氧化钠溶液中
C.铁丝在氯气中燃烧
D.铜和硝酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前,在研究新能源的前沿技术上,科学家致力于二氧化碳的“组合转化”技术的研究,把过多的二氧化碳转化为有益于人类的物质。
(1)乙烯的产量是衡量一个国家石油化工发展水平的标志之一,下列石油化工生产能提高乙烯的产量的是________。
A.蒸馏、分馏
B.催化裂化
C.催化裂解
D.催化重整
(2)下列说法不正确的是__________。
A.石油是混合物,分馏后得到的馏分是纯净物
B.煤隔绝空气加强热可以得到黑褐色油状的煤焦油
C.煤的气化和液化是使煤变成清洁能源的有效途径
D.从绿色化学角度考虑,以植物为主的生物质资源,是未来的理想资源
(3)如果将CO2和H2以1∶4的比例混合,通入反应器,在适当的条件下反应,可获得一种重要的能源。请完成以下化学方程式:
CO2+4H2→()+2H2O
(4)若将CO2和H2以1∶3的比例混合,使之发生反应生成某种重要的化工原料和水,该原料可能是________。
A.烷烃
B.烯烃
C.炔烃
D.芳香烃
(5)甲、乙、丙三个化肥厂生产尿素所用的原料不同,但生产流程相同:
原料— 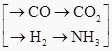 →CO(NH2)2
→CO(NH2)2
①甲厂以焦炭和水为原料;②乙厂以天然气和水为原料;③丙厂以石脑油(主要成分为C5H12)和水为原料。按工业有关规定,利用原料所制得的原料气H2和CO2的物质的量之比,若最接近合成尿素的原料气NH3(换算成H2的物质的量)和CO2的物质的量之比,则对原料的利用率最高。据此判断甲、乙、丙三个工厂哪个工厂对原料的利用率最高?。
(6)请根据以上信息,设计工业合成尿素的条件。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A.淀粉、葡萄糖都是高分子化合物B.煤的干馏是复杂的物理、化学变化
C.C3H7C1有2种同分异构体D.油脂、蛋白质都可以和碱反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】世博园地区改造前,规划区内有一座大型钢铁厂,附近居民曾饱受到该厂产生的棕红色烟雾的困扰.估计这一空气污染物可能含有( )
A.FeO粉尘
B.Fe3O4粉尘
C.Fe2O3粉尘
D.NO2气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】体积相同浓度均为0.1mol·L-1的NaOH溶液、氨水,分别稀释m倍、n倍,溶液的pH都变成9,则m和n的关系正确的是
A.m>nB.m=nC.m<nD.不能确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为迎接G20峰会的到来,浙江加大了对环境治理的力度.其中对含氮化物的处理是一个重要的课题.
(1)氮氧化物
(I)已知:N2(g)和O2(g)反应生成NO(g)过程中的能量变化情况如图1: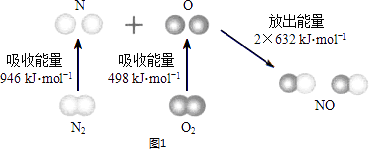
①2NO(g)N2(g)+O2(g)△H=
②你认为该反应能否自发,并说明理由
(II)科学家利用2NO(g)Na(g)+O2(g)来消除NO的污染.1molNO在恒温、容积恒定为1L的密闭容器中反应,10min后达到平衡,NO的物质的量为0.4mol.在第15min时,保持温度不变,将容器的体积迅速增大至2L并保持恒容,第25min时到达平衡;第30min时,保持温度和体积不变,向容器中再通入0.2molNO,第50min时达到平衡,请在图2中画出从第15min起到70minNO的物质的量随时间变化的曲线 . 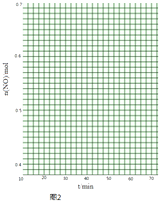
(2)亚硝酸盐
(I)来源:用氧化性熔融盐处理钢铁表面氧化膜时会产生污染物亚硝酸盐,请写出FeO与NaNO3在加热条件下发生的反应 .
(II)电化学处理:用电解法降解NO2其原理如图3所示
电源正极为(填A或B),
阴极反应式为 . 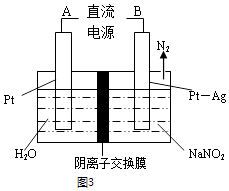
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】试验室中配制950mL2mol/L NaOH溶液,配制时应选用的容量瓶的规格和称取的NaOH的质量分别是( )
A. 950mL,96.0g
B. 500mL,80.0g
C. 1000mL,80.0g
D. 1000mL,76.0g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com