
【题目】试验室中配制950mL2mol/L NaOH溶液,配制时应选用的容量瓶的规格和称取的NaOH的质量分别是( )
A. 950mL,96.0g
B. 500mL,80.0g
C. 1000mL,80.0g
D. 1000mL,76.0g
 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】如图所示,已知A元素的最低化合价为﹣3价,它的最高价氧化物含氧56.21%,原子核内中子数比质子数多1,试回答: 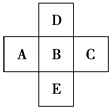
(1)写出它们的元素符号: A , B , C , D , E .
(2)A、B、C、D的气态氢化物稳定性最差的是 .
(3)A、B、C的原子半径由小到大的顺序是 .
(4)A、B、C三元素最高价氧化物对应水化物的酸性由强到弱的顺序是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来“雾霾”污染日益严重,原因之一是机动车尾气中含有NO、NO2、CO等气体,火力发电厂释放出大量的NOx、SO2和CO2等气体也是其原因,现在对其中的一些气体进行了一定的研究:
(1)用 CH4催化还原氮氧化物可以消除氮氧化物的污染.
已知:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=﹣574kJ/mol
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=﹣1160kJ/mol
③H2O(g)=H2O(l)△H=﹣44.0kJ/mol
写出 CH4(g)与 NO2(g)反应生成 N2(g)、CO2(g)和 H2O(l)的热化学方程式: .
(2)汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体转化为无毒气体.4CO(g)+2NO2(g)4CO2(g)+N2(g)△H=﹣1200kJmol﹣1
对于该反应,温度不同(T2>T1)、其他条件相同时,下列图象正确的是(填代号).
(3)用活性炭还原法也可以处理氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+2NO(g)N2(g)+CO2(g)△H=a kJ/mol
在T1℃时,反应进行到不同时间测得各物质的量浓度如表:
时间/min | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.0 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
CO2 | 0 | 0.21 | 0.30 | 0.3 0 | 0.36 | 0.36 |
①根据图表数据分析T1℃时,该反应在0﹣20min的平均反应速率v(NO)=;计算该反应的平衡常数K= .
②30min后,只改变某一条件,根据表的数据判断改变的条件可能是(填字母代号).
A.通入一定量的CO2 B.加入合适的催化剂
C.适当缩小容器的体积 D.通入一定量的NO
E.加入一定量的活性炭
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为2:1:1,则达到新平衡时NO的转化率(填“升高”或“降低”),a0(填“>”或“<”).
(4)温度T1和T2时,分别将0.50mol CH4和1.2mol NO2充入1L的密闭容器中发生反应:CH4(g)+2NO2(g)N2(g)+CO2(g)+2H2O(g)△H=bkJ/mol.测得有关数据如表:
温度 | 时间/min | 0 | 10 | 20 | 40 | 50 |
T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 /td> | 0.10 | 0.10 |
T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | x | 0.15 |
下列说法正确的是
A.T1>T2 , 且b>0
B.当温度为T2、反应进行到40min时,x>0.15
C.温度为T2时,若向平衡后的容器中再充入0.50mol CH4和1.2mol NO2 , 重新达到平衡时,n(N2)<0.70mol
D.温度为T1时,若起始时向容器中充入0.50mol CH4(g)、0.50molNO2(g)、1.0mol N2(g)、2.0molCO2(g)、0.50molH2O(g),反应开始时,ν(正)>ν(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计了如图装置用于制取SO2 , 并验证SO2的部分性质,回答下列问题 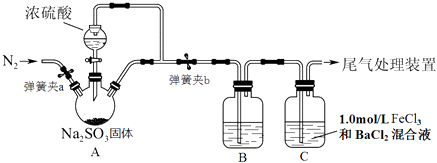
(1)装置A中用于添加浓硫酸的仪器名称为
(2)某同学为了检验装置中A、B两部分的气密性,进行的操作是:关闭弹簧夹a、打开弹簧夹b,用酒精灯在三口烧瓶下微热,观察到B中长导管口有明显气泡现象,他判断气密性良好.你认为是否合理(填“合理”或“不合理”)
(3)实验前要在装置中鼓入N2 , 目的是
(4)为了验证SO2是酸性氧化物,B中可选用的试剂是
A.无色酚酞溶液
B.蓝色石蕊试剂
C.红色品红溶液
D.KI淀粉混合溶液
(5)装置C中可观察到白色沉淀现象,由此可验证SO2具有性,相关反应的总的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2(g)+Br2(g)=2HBr(g)△H=﹣72kJ/mol,其他相关数据如下表:
H2(g) | Br2(g) | HBr(g) | |
1mol分子中的化学键断裂时需要吸收的能量/kJ | 436 | a | 366 |
则表中a为( )
A.404
B.368
C.224
D.200
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝基甲苯有领、间、对三种,其中对硝基甲苯是医药、染料等工业的一种重要有机中间体,它常以浓硝酸为硝化剂,浓硫酸为催化剂,通过甲苯的硝化反应制备.一种新的制备对硝基甲苯的实验方法是:以发烟硝酸为硝化剂,固体NaHSO4为催化剂(可循环使用),在CCl4溶液中,加入乙酸酐(有脱水作用),45℃反应1h.反应结束后,过滤,滤液分别用5%NaHCO3 , 溶液、水洗至中性,再经分离提纯得到对硝基甲苯.
请回答下列问题:
(1)仪器B的名称是 , 其作用是
(2)过滤在分液漏斗中洗涤静后,有机层处于层(填“上”或“下”)放液时,若发现液体流不下来,其可能原因除分液漏斗活塞堵塞外,还有 .
(3)上述新的试验方法中过滤的目的是 , 滤液用5%NaHCO3溶液洗涤的原因是 .
(4)下列给出了催化剂种类及用量对甲苯硝化反应影响的实验结果.
催化剂 | n(催化剂) | 硝化产物中各种异构体质量分数(%) | 总产率 | ||
n(甲苯) | 对硝基甲苯 | 邻硝基甲苯 | 间硝基甲苯 | ||
浓H2SO4 | 1.0 | 35.6 | 60.2 | 4.2 | 82.0 |
1.2 | 36.5 | 59.2 | 4.0 | 83.8 | |
NaHSO4 | 0.25 | 46.3 | 52.8 | 0.9 | 92.8 |
0.32 | 48.0 | 51.7 | 0.3 | 95.0 | |
0.36 | 45.0 | 54.4 | 0.6 | 93.9 | |
催化制备对硝基甲苯时,催化剂与甲苯的最佳物质的量之比为 , 此时若使用13.0g甲苯,分离出对硝基甲苯的质量是g(保留一位小数).
②由表中数据可知甲苯硝化主要得到对硝基甲苯和邻硝基甲苯,原因是 .
③与浓硫酸催化甲苯硝化相比,NaHSO4催化甲苯硝化的优有(回答一条)
④对硝基甲苯和邻硝基甲苯的部分物理特性如表:
密度/gcm﹣3 | 沸点/℃ | 溶解性 | |
甲苯 | 0.866 | 110.6 | 不溶于水,易溶于硝基甲苯 |
对硝基甲苯 | 1.286 | 237.7 | 不溶于水,易溶于液态烃 |
邻硝基甲苯 | 1.162 | 222 | 不溶于水,易溶于液态烃 |

其中,操作1的名称为;操作2中需要使用下列仪器中的(填序号).
A.冷凝管 B.酒精灯 C.温度计 D.分液漏斗 E.蒸发皿.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学键的说法中正确的是
A. 构成单质分子的微粒一定含有共价键
B. 由非金属组成的化合物不一定是共价化合物
C. 非极性键只存在于双原子单质分子里
D. 不同元素组成的多原子分子里的化学键一定是极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中含有丰富的化学元素,下面是某化工厂从海水中提取NaCl、Mg(以MgCl2形式存在)和Br2(以NaBr的形式存在)及综合利用的生产流程简图: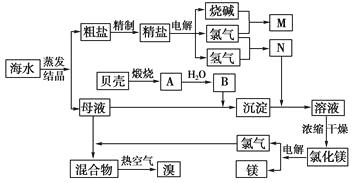
请回答:
(1)Mg(OH)2中加入盐酸后,要获得MgCl2·6H2O晶体,需要进行的实验操作依次为。
A.蒸馏
B.灼烧
C.过滤
D.蒸发
E.冷却结晶
(2)利用MgCl2·6H2O可制得无水氯化镁,应采取的措施是。
(3)目前工业上主要采用隔膜法电解饱和食盐水,下列关于隔膜电解槽的叙述错误的是________。
A.隔膜的作用是防止氯气和氢氧化钠、氯气和氢气接触而发生反应
B.电解之前应除去Ca2+、Mg2+以防止电解时生成Ca(OH)2、Mg(OH)2堵塞隔膜
C.阴极产物为氢氧化钠和氢气
D.电解槽的阳极用金属铁网制成
(4)母液中常含有MgCl2、NaCl、MgSO4 , KCl等,可进一步加工制得一些重要的产品。若将母液加热升温到60℃以上,随着水分的蒸发,会逐渐析出晶体,此晶体的主要成分是;过滤上述晶体后,将滤液降温到30℃以下,又逐渐析出晶体,用一定量的冷水洗涤该晶体,最后可得到比较纯净的晶体。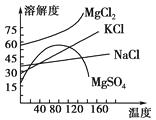
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据碘与氢气反应的热化学方程式: ①I2(g)+H2(g)2HI(g)△H=﹣9.48kJmol﹣1
②I2(s)+H2(g)2HI(g)△H=+26.48kJmol﹣1 .
下列判断正确的是( )
A.反应①的产物比反应②的产物稳定
B.254g I2(g)中通入2gH2(g),反应放热9.48 kJ
C.反应②的反应物总能量比反应①的反应物总能量低
D.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com