
| A. | 简单离子半径:W>Y>X | |
| B. | Z与W形成的化合物在熔融状态下能导电 | |
| C. | 电解Y、W形成的化合物,无论是熔融状态下还是水溶液中,都能得到单质W | |
| D. | 单质X与单质Y加热条件下能生成白色固体 |
分析 X、Y、Z、W为原子序数依次增大的四种短周期元素,X的一种同素异形体具有杀菌、消毒能力,则该物质为O3,所以X为O元素;Y单质与X单质在不同条件下反应会生成2种不同化合物,而且Y的原子序数大于O,所以Y为Na元素;Z的原子序数大于O,而且Z简单离子半径是同周期元素简单离子中最小的,说明Z为Al元素;H2在W单质中燃烧产生苍白色火焰,则W为Cl元素,据此结合元素化合物的性质和元素周期律解答.
解答 解:X、Y、Z、W为原子序数依次增大的四种短周期元素,X的一种同素异形体具有杀菌、消毒能力,则该物质为O3,所以X为O元素;Y单质与X单质在不同条件下反应会生成2种不同化合物,而且Y的原子序数大于O,所以Y为Na元素;Z的原子序数大于O,而且Z简单离子半径是同周期元素简单离子中最小的,说明Z为Al元素;H2在W单质中燃烧产生苍白色火焰,则W为Cl元素,
A.电子层数越多,离子半径越大,电子层数相同时,原子序数越大,离子半径越小,则简单离子半径:Cl->O2->Na+,故A错误;
B.Al与Cl形成的化合物属于共价化合物,在熔融状态下不能导电,故B错误;
C.电解Na、Cl形成的化合物,在熔融状态下电解生成Na和氯气,在水溶液中电解生成氢氧化钠、氢气和氯气,都能得到单质氯气,故C正确;
D.氧气与钠在加热条件下能生成过氧化钠,过氧化钠为淡黄色固体,故D错误,
故选C.
点评 本题考查元素周期律、结构位置性质关系,根据常见元素的单质和化合物的性质推断元素是解题关键,需要学生熟练掌握元素化合物性质,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
| 元素 | 相关信息 |
| A | 在常温、常压下,其单质是气体,随着人类对环境的认识和要求的提高,它将成为备受青睐的清洁燃料 |
| B | 工业上通过分离液态空气获得其单质,其某种同素异形体是保护地球地表环境的重要屏障 |
| C | 植物生长三要素之一,它能形成多种氧化物,其中一种是早期医疗中使用的麻醉剂 |
| D | 室温下其单质为淡黄色粉末状固体,加热易熔化.该单质在氧气中燃烧,发出明亮的蓝紫色火焰 |
| E | 它在地壳中储量丰富,是人体不可缺少的微量元素之一.其单质为银白色固体,是工农业生产中不可或缺的金属材料,常用于机械制备、建筑等行业 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 澄清石灰水,浓H2SO4 | B. | 溴水,浓H2SO4 | ||
| C. | 无水硫酸铜,浓H2SO4 | D. | 浓H2SO4,酸性高锰酸钾溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
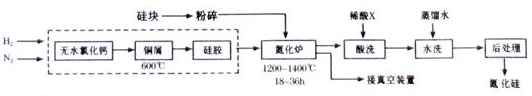
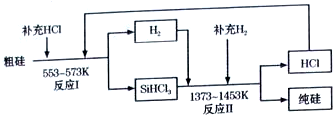
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol羟基(-OH)中所含共价键数 | |
| B. | 1molHCl与KClO3反应生成0.5molCl2转移的电子数 | |
| C. | 1.8 g H2O中所含有的质子数、电子数、中子数 | |
| D. | 常温常压下,22.4LNO和CO混合气体中的O原子个数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 冰醋酸、纯碱、铜绿、生石灰分别属于酸、碱、盐、氧化物 | |
| B. | HClO、H2SO4(浓)、HNO3均具有强氧化性,都是氧化性酸 | |
| C. | Al、Al2O3、Al(OH)3均既能与盐酸反应又能与氢氧化钠反应,都属于两性化合物 | |
| D. | H2SO4、NaOH、AlCl3均为强电解质,都属于离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2CH4(g)+4O2(g)═2CO2(g)+4H2O(l)△H=+890kJ•mol-1 | |
| B. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=+890kJ•mol-1 | |
| C. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=890kJ•mol-1 | |
| D. | $\frac{1}{2}$ CH4(g)+O2(g)═$\frac{1}{2}$CO2(g)+H2O(l)△H=-445kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化镁溶液与氨水反应:Mg2++2OH-═Mg(OH)2↓ | |
| B. | 500℃、30MPa下,将0.5molN2和1.5mol H2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为: N2(g)+3H2(g)?2NH3(g)△H=-38.6kJ•mol-1 | |
| C. | 甲烷的标准燃烧热△H=-890.3kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJ•mol-1 | |
| D. | 氧化铝溶于NaOH溶液:Al2O3+2OH-═2AlO2-+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com