
| A. | 冰醋酸、纯碱、铜绿、生石灰分别属于酸、碱、盐、氧化物 | |
| B. | HClO、H2SO4(浓)、HNO3均具有强氧化性,都是氧化性酸 | |
| C. | Al、Al2O3、Al(OH)3均既能与盐酸反应又能与氢氧化钠反应,都属于两性化合物 | |
| D. | H2SO4、NaOH、AlCl3均为强电解质,都属于离子化合物 |
分析 A、纯碱是碳酸钠属于盐;
B.次氯酸、浓硫酸、硝酸都是氧化性的酸;
C.和酸、碱都能反应生成盐和水的化合物为两性化合物,分为两性氧化物、两性氢氧化物,铝是金属单质;
D.水溶液中完全电离的电解质为强电解质,阴阳离子构成的化合物为离子化合物;
解答 解:A.冰醋酸、铜绿、生石灰分别属于酸、盐、氧化物,纯碱是碳酸钠属于盐,不是碱,故A错误;
B.HClO、H2SO4(浓)、HNO3均具有强氧化性,表现的都是中心元素化合价降低具有的强氧化性,都是氧化性酸,故B正确;
C.Al、Al2O3、Al(OH)3均既能与盐酸反应又能与氢氧化钠反应,Al2O3、Al(OH)3都属于两性化合物,Al是单质不是化合物,故C错误;
D.H2SO4、NaOH、AlCl3均为强电解质,NaOH属于离子化合物,H2SO4、AlCl3均为共价化合物,故D错误;
故选B.
点评 本题考查了物质分类,电解质概念分析,主要是物质性质和概念实质的理解应用,掌握基础是关键,题目较简单.


科目:高中化学 来源: 题型:选择题
| A. | K+、Cu2+、NO3-、SO42-- | B. | K+、Na+、Cl-、SiO32- | ||
| C. | Al3+、NH4+、NO3-、Cl- | D. | K+、Na+、AlO2-、Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在蒸馏水中滴加浓H2SO4,Kw不变 | |
| B. | CaCO3不易溶于稀硫酸,也不易溶于醋酸 | |
| C. | NaCI溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 | |
| D. | 在Na2S稀溶液中,c(H+)=c( OH-)-2c(H2S)-c(HS-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子半径:W>Y>X | |
| B. | Z与W形成的化合物在熔融状态下能导电 | |
| C. | 电解Y、W形成的化合物,无论是熔融状态下还是水溶液中,都能得到单质W | |
| D. | 单质X与单质Y加热条件下能生成白色固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
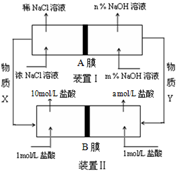 将氯碱工业与燃料电池联合能够有效降低能源消耗,如图是该工艺的图示(电源及电极未标出),则下列说法错误的是( )
将氯碱工业与燃料电池联合能够有效降低能源消耗,如图是该工艺的图示(电源及电极未标出),则下列说法错误的是( )| A. | 装置I为电解池,装置II为原电池 | |
| B. | 物质X为氯气,物质Y为氢气 | |
| C. | A膜为阳离子交换膜,B膜为阴离子交换膜 | |
| D. | 装置Ⅰ中,m小于n,装置II中a等于1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
 |  |  | 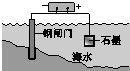 |
| 钢铁表面水膜的酸性很弱或呈中性,发生吸氧腐蚀 | 钢铁表面水膜的酸 性较强,发生析氢 腐蚀 | 将锌板换成铜板对 钢闸门保护效果更好 | 钢闸门作为阴极而受到保护 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5υ(O2)=4υ(NH3) | B. | 6υ(H2O)=5υ(O2) | C. | 3υ(H2O)=2υ(NH3) | D. | 5υ(NO)=4υ(O2) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 事实或实验 | 结论 |
| A | 原电池可将化学能转化为电能 | 原电池需外接电源才能工作 |
| B | 向某溶液中滴加氯水,再加入KSCN溶液,溶液呈红色 | 原溶液中一定含有Fe2+ |
| C | 汽车尾气净化反应2NO(g)+2CO(g)=N2(g)+2CO2(g)的△S<0 | 该反应在常温不能自发进行 |
| D | 向NaBr溶液中滴入少量氯水和CCl4,振荡,静置溶液下层呈红色 | Br-还原性强于Cl- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com