
【题目】在铜锌原电池中,锌电极上发生的反应为Zn-2e-=Zn2+,则( )
A. 锌电极为负极 B. 锌电极为正极
C. 电子从铜电极流向锌电极 D. 反应中Zn被还原
科目:高中化学 来源: 题型:
【题目】醋酸的电离方程式为CH3COOH(aq)![]() H+(aq)+CH3COO-(aq) ΔH>0。25℃时,0.1mol/L醋酸溶液中存在下述关系:Ka=c(H+).c(CH3COO-)/c(CH3COOH)=1.75×10-5,其中的数值是该温度下醋酸的电离平衡常数(Ka)。下列说法正确的是
H+(aq)+CH3COO-(aq) ΔH>0。25℃时,0.1mol/L醋酸溶液中存在下述关系:Ka=c(H+).c(CH3COO-)/c(CH3COOH)=1.75×10-5,其中的数值是该温度下醋酸的电离平衡常数(Ka)。下列说法正确的是
A. 向该溶液中滴加几滴浓盐酸,平衡逆向移动,c(H+)减小
B. 向该溶液中加少量CH3COONa固体,平衡正向移动
C. 该温度下0.01mol/L醋酸溶液Ka<1.75×10-5
D. 升高温度,c(H+)增大,Ka变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B的结构简式如下:

(1)A分子中含有的官能团的名称是____________________________________。
(2)A、B能否与NaOH溶液反应:A________(填“能”或“不能”,下同),B________。
(3)A在浓硫酸作用下加热可得到B,其反应类型是____________________。
(4)A、B各1 mol分别加入足量溴水,完全反应后消耗单质溴的物质的量分别是________mol、________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图是一个简易测量物质反应是吸热反应还是放热反应的实验装置,利用此装置可以很方便地测得某反应是放热反应还是吸热反应。将镁片加入小试管内,然后注入足量的盐酸,请根据要求完成下列问题:
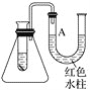
(1)有关反应的离子方程式是_________________________________________,
试管中看到的现象是________________________________________。
(2)U形管中液面A________(填“上升”或“下降”),原因是__________________;
说明此反应是________(填“放热”或“吸热”)反应。
(3)由实验推知,MgCl2溶液和H2的总能量________(填“大于”“小于”或“等于”)镁片和盐酸的总能量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是分别位于第2、3周期的元素,原子序数依次递增。X与Z位于同一主族,Y元素的单质既能与盐酸反应也能与NaOH溶液反应,Z原子的最外层电子数是次外层电子数的一半,Y、Z、W原子的最外层电子数之和为14。下列说法正确的是( )
A. 原子半径由小到大的顺序:X< Y < Z< W
B. Z的最高价氧化物能与水反应生成相应的酸
C. Y单质在一定条件下可以与氧化铁发生置换反应
D. X、Z的氧化物形成的晶体类型相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温、容积为2 L的密闭容器中充入2 mol SO2和一定量O2。发生反应2SO2+O2 ![]() 2SO3,当反应进行到4 min时,测得n (SO2)=0.4 mol。若反应进行到2 min时,容器中SO2的物质的量是
2SO3,当反应进行到4 min时,测得n (SO2)=0.4 mol。若反应进行到2 min时,容器中SO2的物质的量是
A. 等于1.6 mol B. 等于1.2 mol
C. 小于1.2 mol D. 大于1.6 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄血盐[亚铁氰化钾,K4Fe(CN)6]目前广泛用做食盐添加剂(抗结剂),我国卫生部规定食盐中黄血盐的最大使用量为10mg·kg-1。一种制备黄血盐的工艺如下:

回答下列问题:
(1)步骤Ⅰ反应的化学方程式为_____________________________。
(2)步骤Ⅳ过滤所得的废液中含量较多的溶质为_______________________。(填化学式)
(3)步骤Ⅴ所用的试剂X是_________________。
(4)工艺中用到剧毒的HCN 溶液,含CN-的废水必须处理后才能排放。己知氢氰酸是一种具有苦杏仁特殊气味的无色剧毒液体,易挥发,25℃时,Ka(HCN)=6.25×10-10。
①NaCN 的电子式为_________________,反应CNˉ +H2O![]() HCN+OHˉ在25℃时的平衡常数 K= _________________。(填数值)
HCN+OHˉ在25℃时的平衡常数 K= _________________。(填数值)
②处理含CN-废水的方法是:第一步控制pH>10,用NaClO溶液先将CN-“不完全氧化”为OCN-;第二步控制 pH为7.5~8.5,用NaClO“不完全氧化”OCNˉ生生成N2和两种盐。
第一步控制强碱性的主要目的是__________________________________。
第二步反应的离子方程式为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列所给物质的性质和用途具有对应关系的是
A.一氧化碳具有还原性——冶炼金属
B.碳酸氢铵受热易分解——化肥
C.氯气能溶于水——自来水消毒
D.二氧化硫具有还原性——漂白剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某浅黄色固体XY和焦炭混合,加强热。发生如下反应:

先通入氮气。然后点燃Ⅰ、Ⅲ酒精灯,实验中观察到Ⅰ生成银白色金属,Ⅱ、Ⅳ中溶液变浑浊。Ⅲ中黑色粉未变红色粉末。下列推断不正确的是
A. 开始通入氮气的目的是排尽装置中的空气
B. XY与焦炭在高温下反应生成CO2和CO
C. X可能是钠,Y一定是氧元素
D. 用燃烧法处理Ⅳ排放的尾气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com