
| 3 |
| 2-x+1-0.5x+x |
| 1 |
| 1-30% |
| 1.8mol |
| 2mol |


科目:高中化学 来源: 题型:
| A、中和热的测定(量筒、温度计、酒精灯) |
| B、从溴水中提取溴单质(分液漏斗、无水乙醇、玻璃棒) |
| C、探究浓硫酸与铜反应的产物(蘸有碳酸钠溶液的棉花团、蒸馏水、烧杯) |
| D、制氢氧化铁胶体(饱和FeCl3溶液、NaOH溶液、胶头滴管) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、石油分馏、煤的干馏均是物理变化 |
| B、PM2.5是指氮、硫的氧化物溶于水形成的酸性液体造成的空气污染 |
| C、资源的“3R”即减少消耗(Reduce)、增加重复使用(Reuse)、重复再生(Recycle)有利于实现“低碳生活” |
| D、铅蓄电池、锂电池、碱性锌锰干电池都属于二次电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、不能使酚酞试液变红的无色溶液中:Na+、CO32-、K+、C1O-、I- |
| B、能与金属铝反应放出氢气的溶液中:K+、NO3-、C1-、NH4+ |
| C、常温下水电离出的c(H+)?c(OH-)=10-20的溶液中:Na+、Cl-、S2-、SO32- |
| D、无色透明溶液:K+、HCO3-、NO3-、SO42-、Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
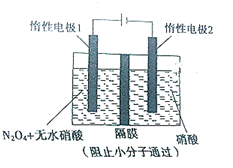 用如图装置电解制备N2O5 ,下列有关说法正确的是( )
用如图装置电解制备N2O5 ,下列有关说法正确的是( )| A、N2O5在惰性电极2处产生 |
| B、在惰性电极2处有氢气产生 |
| C、在惰性电极1处发生还原反应 |
| D、在惰性电极2处有NO产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:
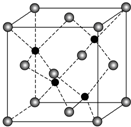 X、Y、Z、R、Q为前四周期元素,且原子序数依次增大,其中Y原子核外2p能级上有1个电子,R原子L层上有2对成对电子,X与Z可形成共价化合物ZX3,Q原子在第四周期中未成对电子数最多.请回答下列问题:
X、Y、Z、R、Q为前四周期元素,且原子序数依次增大,其中Y原子核外2p能级上有1个电子,R原子L层上有2对成对电子,X与Z可形成共价化合物ZX3,Q原子在第四周期中未成对电子数最多.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、7.8 g Na2O2含有的阴离子数目为0.2 NA |
| B、PH=2的醋酸冲稀10倍后,溶液中H+数目大于0.001NA |
| C、1 mol FeCl3跟水完全反应转化为氢氧化铁胶体后,胶体粒子的数目小于NA |
| D、1.8 g重水(D2O)中含NA个质子和NA个中子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cl2是氧化产物,KCl是还原产物 |
| B、盐酸在该反应中只表现还原性 |
| C、每生成3 mol Cl2,有1 mol KClO3发生氧化反应 |
| D、每转移0.1 mol电子,能生成标准状况1344mLCl2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com