
����Ŀ�����ճ����������У����ǻ��������ָ����Ļ�ѧ��Ӧ�����з�Ӧ����������ԭ��Ӧ����
A. ����Ȼ������Ҫ�ɷ�ΪCH4������ú����Ϊȼ��
B. ����ˮ����ͭ��CuSO4�����鹤ҵ�ƾ����Ƿ���������ˮ
C. ����ʯ�ң�CaO��Ͷ��ˮ�У����ɵõ������õ���ʯ��[Ca(OH)2]
D. ̼泥�NH4HCO3����һ�ֳ��õĻ��ʣ�Ӧ����������������Ϊ�ڽϸ��¶��£�����ֽ����ɰ�����ˮ�Ͷ�����̼

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ѧϰ���о���ѧ��һ�ֳ��ÿ�ѧ���������з���˵����������
A. �����Ƿ�ֻ��һ��Ԫ�ؽ����ʷ�Ϊ���ʺͻ�����
B. �ǽ��������ﲻһ��������������
C. ����һ�ֵ��ʺ�һ�ֻ�����ķ�Ӧһ�����û���Ӧ
D. ����������е���ԭ�Ӹ��������ΪһԪ������Ԫ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڰ�����ε���������ȷ����( )
A.��δ�������ˮ
B.���� NH3 ʱ�������������Ը�����������Ը����CaCl2 ����
C.���������ʱ������ʯ�һ��õ�Ч������
D.��μ���ʱ���ܲ��� NH3����������ʪ��ĺ�ɫʯ����ֽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijԪ��R����������RN+ �� �����x�����ӣ���������ΪA����R����������Ϊ�� ��
A.A��X+N
B.A��X��N
C.A+X+N
D.A��N+X
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ�����ڱ���ѧϰ��ѧ����Ҫ���ߣ���ͼ��ʾΪԪ�����ڱ��е�һ���֡��������е���ĸ�ֱ������Ӧ�Ļ�ѧԪ�ء�
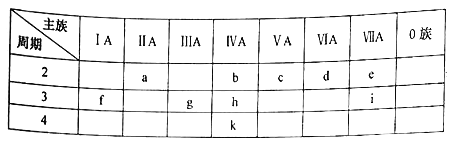
��1������Ԫ���У���������ǿ��Ԫ�������ڱ��е�λ����______������������Ӧˮ������������ǿ��Ԫ����___________(��Ԫ�ط���)�������£��䵥����Ũ�����лᷢ���ۻ���Ԫ����_______(��Ԫ�ط���)��
��2��Ԫ��g�ļ����ӽṹʾ��ͼΪ______��Ԫ��d��һ���⻯��������ԭ�ӵĸ�����Ϊ1: 1��������ʵĵ���ʽΪ___________
��3��kԪ�ؿ��ܵ����ʻ�Ӧ����________��
A.��һ�ֻ��õĽ���Ԫ�� B.����⻯������ȶ��Ա�hǿ
C.�䵥�ʿ���Ϊ�뵼����� D.��������ϼ�Ϊ+4
��4������˵����ȷ����________
A.�����Ӱ뾶�Ĵ�С˳��: r(d>r(e>r(g)>r(f)
B.Ԫ�طǽ�������ǿ������˳��:e>d>c
C.f��g��i����������Ӧ��ˮ��������֮���ܷ�����Ӧ
D.������f2d2�У����������Ӹ���֮��Ϊ1:1
��5��Ԫ��a��Ԫ��g�����ƵĻ�ѧ���ʡ���д��Ԫ��a������������NaOH��Һ��Ӧ�Ļ�ѧ����ʽ:_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ˮ���ʵ������в���ȷ����
A. �۲���ˮ����ɫ��������ˮ�ʻ���ɫ��˵����ˮ�д���Cl2
B. ����ˮ�е���̼������Һ�����������ɣ�˵����ˮ�д���H+
C. ����ˮ�еμ���������Һ���а�ɫ�������ɣ�˵����ˮ�д���Cl��
D. ��ˮ�����պ���ɫ����ʧ���ų����壬������Һ�����Լ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йص������Һ��������ȷ����
A. ����ʱ��Ka=1��10-5Ũ��Ϊ0.1mol/L ��HA ��Һ��pH=3
B. ��0.10mol��L-1NH4HCO3��Һ��ͨCO2����ҺpH=7��c(NH4+)=c(HCO3-)+c(CO32-)
C. �ڱ���AgCl��AgBr�Ļ����Һ�м�������AgNO3��Һ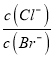 ����
����
D. 25��ʱ����20mL0.01mol/L�Ĵ�����Һ�еμ�10mL0.01mol/L��KOH��Һ�������Һ������ԣ�c(K+) + c(H+)3COOH)+c(OH-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ժ��ܷϴ�������Ҫ�ɷ�ΪCo��Fe��SiO2��Ϊԭ�ϣ���ȡ�����ܵ��������£�
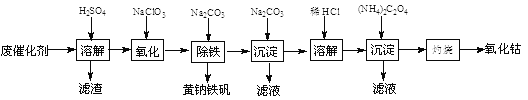
��1���ܽ⣺�ܽ����ˣ�������ϴ��2��3�Σ���������Ҫ�ɷ���________�����ѧʽ��
��2�����������Ƚ��������¼���NaClO3����Fe2+������Fe3+�������ӷ���ʽ��________________��
��֪�����軯�ػ�ѧʽΪK3[Fe(CN)6]�������軯�ػ�ѧʽΪK4[Fe(CN)6]��3H2O��
3Fe2++ 2[Fe(CN)6]3- = Fe3[Fe(CN)6]2������ɫ������
4Fe3++ 3[Fe(CN)6 ]4- = Fe4[Fe(CN)6]3������ɫ������
ȷ��Fe2+�Ƿ�������ȫ�ķ�����__________________________________________�����ɹ�ѡ����Լ������軯����Һ�������軯����Һ�����ۡ�KSCN��Һ��
��3������������������Na2CO3������ȣ����ɻ�������[Na2Fe6(SO4)4(OH)12]������д���÷�Ӧ�Ļ�ѧ����ʽ��______________________________________��
��4�����������ɳ�����ʽ̼����[(CoCO3)2��3Co(OH)2]��������ϴ�ӣ�ϴ�ӵIJ�����_______________________��
��5���ܽ⣺CoCl2���ܽ��������ͼ��ʾ�����ʽ̼�����м�������ϡ���ᣬ���ȱ߽�������ȫ�ܽ������ȹ��ˣ���ԭ����___________________________��
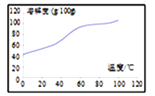
��6������������һ����Ҫ�Ļ��������������ʴ��·�塣�����£�ij��ʴ��Һ�к���0.5 molL-1 Fe3+ ��0.26 molL-1 Cu2+����ʹFe3+��ȫ����[c(Fe3+)<4��10-5 molL-1ʱ��ȫ����]��Cu2+�����������������Һ pH�ķ�ΧΪ_________________�� {KspCu(OH)2]=2.6��10-19 ��KspFe(OH)3]=4��10-38}
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������У��仯ѧ��������ȫ��ͬ���ǣ� ��
A.NH3��H2O
B.HCl��KCl
C.H2O��H2O2
D.NaCl��NaOH
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com