
 Fenton法常用于处理含难降解有机物的工业废水,通常先调节好Fe2+等离子的浓度,再向废水中加入H2O2,所产生的羟基自由基(Fe2++H2O2→Fe3++OH-+HO?)能氧化降解污染物.如:降解废水中丙二醇(分子式C3H8O2)的反应为:C3H8O2+8H2O2
Fenton法常用于处理含难降解有机物的工业废水,通常先调节好Fe2+等离子的浓度,再向废水中加入H2O2,所产生的羟基自由基(Fe2++H2O2→Fe3++OH-+HO?)能氧化降解污染物.如:降解废水中丙二醇(分子式C3H8O2)的反应为:C3H8O2+8H2O2| FeSO4 |
| FeSO4 |


 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:
| A、将少量SO2气体通入NaClO溶液中:SO2+2ClO-+H2O=SO32-+2HClO |
| B、向氯化铝溶液中加入氨水:Al3++3OH-=Al(OH)3↓ |
| C、向Ca(HCO3)2溶液中滴入过量的NaOH溶液:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O |
| D、单质钠与水反应:Na+2H2O=Na++2OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、温度下降10℃,两倍溶液的pH均不变 |
| B、分别加水稀释10倍,两溶液的pH仍相等 |
| C、用同溶液的盐酸中和,消耗的盐酸体积相同 |
| D、加入适量的氯化铵晶体,两溶液的pH均减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在含大量Fe3+的溶液中:NH4+、Na+、Cl-、SCN- |
| B、在强碱溶液中:Na+、K+、AlO2-、CO32- |
| C、在有SO42-存在的溶液中:Na+、Mg2+、Ca2+、I- |
| D、在酸性溶液中:K+、MnO4-、Fe2+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ba(OH)2?8H2O与NH4Cl反应 |
| B、铝与稀盐酸反应 |
| C、灼热的炭与CO2反应 |
| D、甲烷与O2的燃烧反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
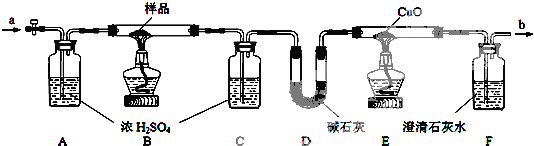
| 样品的质量 | C装置增重 | D装置增重 | E装置减轻 |
| 12.6g | 5.4g | 4.4g | 1.6g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙醇中含有少量水可加入生石灰再蒸馏制得无水乙醇 |
| B、蔗糖水解用浓硫酸作催化剂 |
| C、在鸡蛋白溶液中加入浓HNO3,微热后会生成黄色物质 |
| D、油脂皂化反应后,反应混合物中加入食盐可将肥皂分离出来 |
| E、植物油和裂化汽油可用溴水鉴别 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com