
【题目】现有金属单质A、B、C和气体甲、乙、丙以及物质D、E、F、G、H,它们之间的相互转化关系如图所示(图中有些反应的生成物和反应的条件没有标出)。
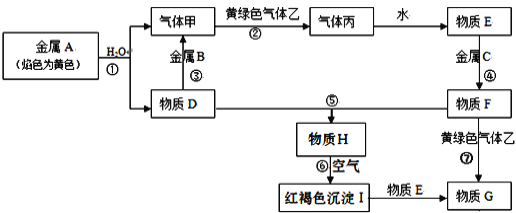
请回答下列问题:
(1)反应③的离子方程式___。
(2)反应⑥化学方程式____。
(3)反应⑦的离子方程式____;物质H在空气中的现象____。
(4)D溶液中加入B的氧化物固体的离子反应方程式为___,向反应后的溶液中通入过量CO2的离子反应方程式为___。
【答案】2Al+2OH-+2H2O=2AlO2-+3H2↑ 4Fe(OH)2+O2+2H2O=4Fe(OH)3 2Fe2++Cl2=2Fe3++2Cl- 白色沉淀迅速变为灰绿色,最终变为红褐色 Al2O3+2OH-=2AlO2-+H2O AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
【解析】
金属A的焰色反应为黄色可知A为Na,A与水反应生成气体甲为H2,D为NaOH;金属B和氢氧化钠溶液反应,说明B为Al,黄氯色气体乙为Cl2,气体甲和氯气反应生成丙为HCl,物质E为盐酸溶液。物质D氢氧化钠和物质F为反应生成沉淀H为Fe(OH)2,在空气中转化为红褐色沉淀I为Fe(OH)3,I与E反应生成物质G,则G为FeCl3,则F为FeCl2、C为Fe。
(1)反应③为Al和NaOH反应,离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑;
(2)反应⑥为Fe(OH)2转化为Fe(OH)3.化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(3)反应⑦为FeCl2和Cl2的反应,离子方程式2Fe2++Cl2=2Fe3++2Cl-;Fe(OH)2溶液被氧气氧化,在空气中白色沉淀迅速变为灰绿色,最终变为红褐色;
(4)Al2O3和NaOH反应生成NaAlO2,通入CO2,生成Al(OH)3沉淀,方程式为Al2O3+2OH-=2AlO2-+H2O,AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-。


科目:高中化学 来源: 题型:
【题目】利用元素的化合价推测物质的性质是化学研究的重要手段。如图是硫元素的常见化合价与部分物质类别的对应关系:
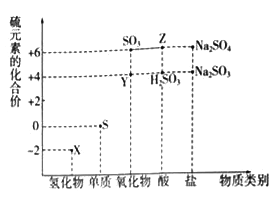
(1)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有_______(填化学式)。
(2)将X与Y混合,可生成淡黄色固体,该反应中氧化剂与还原剂的物质的量之比为_______。
(3)Z的浓溶液与铜单质在一定条件下可以发生化学反应,该反应的化学方程式为_______。
(4)Na2S2O3是重要的化工原料.从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是______(填代号)。
a.Na2S+S b.Na2SO3+S c.SO2+Na2SO4 d.Na2SO3+Na2SO4
(5)已知Na2SO3能被K2Cr2O7氧化为Na2SO4则24mL 0.05molL﹣1的Na2SO3溶液与 20mL 0.02molL﹣1的K2Cr2O7溶液恰好反应时,Cr元素在还原产物中的化合价为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子的检验方法正确的是
A.向待测液中先加入硝酸钡溶液有白色沉淀,再加入稀盐酸,白色沉淀不消失,可以确认待测液中含有SO![]()
B.向待测液中加入NaOH溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝,可以确认待测液中含有NH![]()
C.向待测液中先加入氯水,再滴入KSCN溶液,溶液变红,可以确认待测液中含有Fe2+
D.用玻璃棒蘸取待测液并在酒精灯火焰上灼烧,火焰呈黄色,可以确认待测液中含有Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】格氏试剂在有机合成方面用途广泛,可用卤代烃和镁在醚类溶剂中反应制得。
设R为烃基,已知RX +Mg![]() R-MgX(格氏试剂)
R-MgX(格氏试剂)
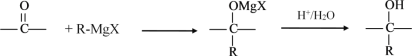
阅读以下合成路线图,回答有关问题:

(1)反应I的类型是____________,反应II的条件是____________。
(2)反应III的化学方程式为____________。
(3)E的同分异构体中,含有苯环且能发生银镜反应的有机物共有____________种。
(4)有机物![]() 是合成药物中的一种原料,实验室可用下列合成路线合成该有机物:
是合成药物中的一种原料,实验室可用下列合成路线合成该有机物:
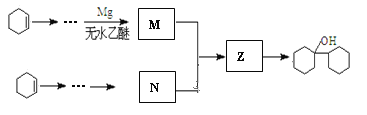
其中Z的结构简式为____________,用反应流程图表示以环己烯(![]() )为有机原料合成有机物N。____________
)为有机原料合成有机物N。____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】400K、101.3Kpa时,1.5L某烃蒸气能在aL氧气中完全燃烧,体积增大至(a+3)L(相同条件下),若a=8时,该烃可能的分子式( )
A.CH4B.C2H6C.C3H8D.C4H8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组的同学对实验室乙酸乙酯的制取和分离进行了实验探究。
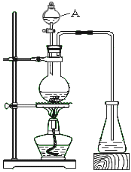
(制备)下列是该小组同学设计的实验装置。回答下列问题:
(1)仪器A的名称____________。
(2)装置中长导管的主要作用除导气外,还有一个作用是____________。
(分离)锥形瓶中得到的产物是乙酸乙酯、乙酸、乙醇的混合物,为了分离该混合物,设计了如下流程:
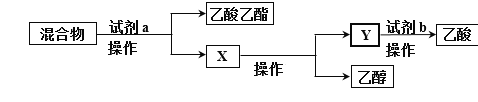
(3)试剂a是_______,试剂b是_______;操作Ⅰ是_______,操作Ⅱ是_______。(填写序号)
①稀硫酸 ②饱和Na2CO3溶液 ③蒸馏 ④分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,判断下列叙述中正确的是

A.每生成2分子AB吸收bkJ热量
B.断裂1molA-A键和1molB-B键,放出akJ能量
C.该反应中反应物的总能量高于产物的总能量
D.该反应热为(a-b)kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4超干重整CO2技术可得到富含CO的化工原料。回答下列问题:
(1)CH4超干重整CO2的催化转化如图所示:

①关于上述过程Ⅱ的说法不正确的是________(填序号)。
a.实现了含碳物质与含氢物质的分离
b.可表示为CO2+H2=H2O(g)+CO
c.CO未参与反应
d.Fe3O4、CaO为催化剂,降低了反应的ΔH
②其他条件不变,在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,反应CH4(g)+CO2(g)=2CO(g)+2H2(g)进行相同时间后,CH4的转化率随反应温度的变化如图所示。a点所代表的状态_________(填“是”或“不是”)平衡状态;b点CH4的转化率高于c点,原因是_________________________________________。
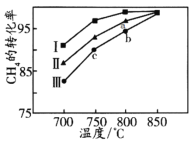
(2)在一刚性密闭容器中,加入Ni/α-Al2O3催化剂并加热至1123K,使CH4和CO2发生反应CH4(g)+CO2(g)=2CO(g)+2H2(g),初始时CH4和CO2的分压分别为20kPa、25kPa,研究表明CO的生成速率υ(CO)=1.3×10-2·p(CH4)·p(CO2)mol·g-1·s-1,某时刻测得p(CO)=20kPa,则p(CO2)=________kPa,υ(CO)=________mol·g-1·s-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室有NaHSO4、Ba(OH)2、NH3·H2O、NaHCO3、KAl(SO4)2五种无色溶液,现欲通过它们之间的相互反应的现象对其进行鉴别。部分物质间的反应现象如表。
A | B | C | D | E | |
A | ↓ | ||||
B | ↑ | ↓ | |||
C | ↑ | ↑↓ | ↓ | ||
D | ↓ | ↑↓ | ↓ | ||
E | ↓ | ↓ | ↓ |
表中“↑”表示生成气体物质,“↓”表示生成沉淀。根据以上信息,回答以下问题。
(1)B,E的化学式分别为________、________。
(2)写出A的电离方程式:_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com