
【题目】某有机物的结构简式为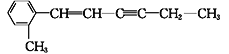 。下列关于该有机物分子结构的说法中正确的是
。下列关于该有机物分子结构的说法中正确的是
A. 最多有18个原子在同一平面内 B. 最多有4个碳原子在一条直线上
C. 最多有12个碳原子在同一平面内 D. 所有原子都可能在同一平面内
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】可逆反应2A+2BC+3D 各物质均为气体在不同情况下测得有下列 4 种反应速率, 其中反应最快的是
A.v(A)=0.45mol·(L·s)![]() B.v(B)=0.6mol·(L·s)
B.v(B)=0.6mol·(L·s)![]()
C.v(C)=0.5mol·(L·s)![]() D.v(D)=0.4mol·(L·s)
D.v(D)=0.4mol·(L·s)![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向圆底烧瓶中加入1 molC2H5OH和含1molHBr的氢溴酸,溶液中发生反应:C2H5OH+HBr![]() C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是( )
C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是( )
A. 加入NaOH溶液,可增大乙醇的物质的量
B. 增大氢溴酸的浓度,有利于生成C2H5Br
C. 若反应物均增大至2 mol,则两种反应物平衡转化率之比变大
D. 若起始温度提高至60℃,有利于提高C2H5Br的产量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中利用含银废料(主要含有AgNO3和AgCl)制取硝酸银的实验步骤如下:
步骤1:向废液中加入足量的NaCl溶液,将所得沉淀过滤,并洗涤干净。
步骤2:将沉淀放入烧杯,并放入铝片,再加入20%的Na2CO3溶液至浸没固体,加热搅拌,至沉淀变为灰白色[含有Ag、Al(OH)3和少量仍未反应的AgCl]。取出铝片,过滤并洗涤沉淀。
步骤3:……
(1)步骤1中检验所加NaCl溶液已经足量的方法是________________。
(2)步骤2加热时还产生能使澄清石灰水变浑浊的气体。写出该过程中发生反应的离子方程式:________________________________。
加入足量稀盐酸,充分反应后,过滤;洗涤沉淀,向沉淀中加入足量稀硝酸,充分反应后,过滤;将所得滤液蒸发浓缩、冷却结晶,过滤;用冰水洗涤、干燥,得到硝酸银晶体(实验中必须使用的试剂有:稀盐酸、稀硝酸、冰水)。
(3)已知:Ag++SCN-=AgSCN↓(白色)。实验室可通过如下过程测定所制硝酸银样品的纯度(杂质不参与反应):
①称取2.000g制备的硝酸银样品,加水溶解,定容到100mL。溶液配制过程中所用的玻璃仪器除烧杯、玻璃棒外还有_________。
②准确量取25.00mL溶液,酸化后滴入几滴铁铵钒[NH4Fe(SO4)2]溶液作指示剂,再用0.1000 mol·L-1NH4SCN标准溶液滴定。滴定终点的实验现象为________。
③重复②的操作两次,所用NH4SCN标准溶液的平均体积为29.00mL。则硝酸银的质量分数为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)是一种重要的工业盐,易溶于水,微溶于乙醇。某化学兴趣小组对亚硝酸钠进行多角度探究:
Ⅰ.亚硝酸钠的制备。

(1)装置B的作用是___________________________________________。
(2)D中澄清石灰水变浑浊,则C中制备NaNO2的离子方程式为______________。
Ⅱ.探究亚硝酸钠与硫酸反应的气体产物成分。
已知:①NO+NO2+2OH-=2NO+H2O
②气体液化的温度:NO2为21 ℃,NO为-152 ℃
(3)反应前应打开弹簧夹,先通入一段时间氮气,目的是_______________________。
(4)仪器的连接顺序(按左→右连接):A→C→________。
(5)在关闭弹簧夹,打开分液漏斗活塞,滴入70%硫酸后,装置A中产生红棕色气体。
①确认装置A中产生的气体含有NO,依据的现象是_______________________。
②若D中通入过量O2,装置B中的化学方程式是_______________________。
Ⅲ.设计实验证明酸性条件下NaNO2具有氧化性。
(6)供选用的试剂:NaNO2溶液、KMnO4溶液、Fe2(SO4)3溶液、KI溶液、稀硫酸、淀粉溶液、KSCN溶液___________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物结构简式为 ,下列叙述不正确的是( )
,下列叙述不正确的是( )
A. 1 mol 该有机物在加热和催化剂作用下,最多能和4 mol H2反应
B. 该有机物能使溴水褪色,也能使酸性KMnO4溶液褪色
C. 该有机物遇硝酸银溶液产生白色沉淀
D. 该有机物在一定条件下能发生消去反应或取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下面的反应路线及所给信息填空:
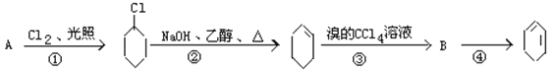
(1)A的结构简式是_____________,名称是_______________________;
(2)①的反应类型______________,②的反应类型__________________;
(3)反应②的化学方程式_______________________________;
反应④的化学方程式______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应A(g) + 3B(g)![]() 2C(g) + D(g),若在某时间段内以A的浓度变化表示的化学反应速率为1mol·L-1·min-1,则在此时间段内以C的浓度变化表示的化学反应速率为
2C(g) + D(g),若在某时间段内以A的浓度变化表示的化学反应速率为1mol·L-1·min-1,则在此时间段内以C的浓度变化表示的化学反应速率为
A. 0.5 mol·L-1·min-1B. 2 mol·L-1·min-1
C. 3 mol·L-1·min-1D. 1 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由P、S、Cl、Ni等元素组成的新型材料有着广泛的用途,回答下列问题。
(1)基态Cl原子核外电子排布式为____,P、S、Cl的第一电离能由大到小顺序为____。
(2)SCl2分子中的中心原子杂化轨道类型是____,该分子构型为_____。
(3)Ni与CO能形成配合物Ni(CO)4,该分子中配位键个数为____;以“—”表示σ键、“→”表示配位键,写出Ni(CO)4分子的结构式____。
(4)已知MgO与NiO的晶体结构(如图)相同,其中Mg2+和Ni2+的离子半径分别为66 pm和69pm。则熔点:MgO_____NiO(填“>”、“<”或“=”),理由是____。
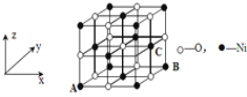
(5)若NiO晶胞中离子坐标参数A为(0,0,0),B为(1,1,0),则C离子坐标参数为____。
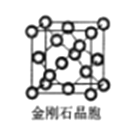
(6)金刚石晶胞含有___个碳原子。若碳原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,则r= ______a,列式表示碳原子在晶胞中的空间占有率____(请用r和a表示不要求计算结果)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com