
【题目】(1)用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图如下:

c电极的反应方程式为:__________________________。
(2)有机物C4H10与氯气发生取代反应,生成的一氯代物有_______种。
(3) 已知反应H2(g)+Br2(l)2HBr(g)在25 ℃、101 kPa下进行,放出热量为72 kJ,蒸发1 mol Br2(l)需要吸收的能量为30 kJ,其他相关数据如下表:
H2(g) | Br2(g) | HBr(g) | |
1 mol分子中的化学键断裂时需要吸收的能量/kJ | 436 | a | 369 |
则表中a为(_____________)
(4) 元素周期表中第ⅦA族元素的单质及其化合物的用途广泛。

一定条件,在水溶液中1 mol Cl-、ClOX-(x=1,2,3,4)的能量(KJ)相对大小如上图所示。
①D是__________(填离子符号)。
②B→A+C反应的离子方程式为__________________;
【答案】CH3OH-6e-+H2O===CO2+6H+ 4 230 ClO4- 3ClO-=ClO3-+2Cl-
【解析】
(1)因c是电子流出的一极,则c为负极,d为正极,CH3OH具有还原性,在负极上发生氧化反应生成CO2,电极反应式为:CH3OH-6e-+H2O=CO2+6H+;
(2)分子式为C4H10的烷烃为丁烷,丁烷存在正丁烷和异丁烷两种同分异构体,正丁烷CH3CH2CH2CH3有2氢原子,所以其一氯代物有2;
异丁烷CH3CH(CH3)CH3有2氢原子,其一氯代物有2种,所以丁烷的一氯代物的同分异构体总共有4种;
(3)在H2(g)+Br2(l)=2HBr(g)△H=-42kJ/mol反应中,1mol Br2(g)液化放出的能量为30kJ,即Br2(g)=Br2(l)△H=-30kJ/mol,则H2(g)+Br2(g)=2HBr(g)△H=-72kJ/mol,反应热等于反应物的总键能减生成物的总键能,则-72=436+a-2×369,a=230;
(4)①根据图象知,D中Cl元素化合价为+7价,所以ClOx-中x为4,则D为ClO4-;
②B→A+C,根据转移电子守恒得该反应的离子方程式为3ClO-=ClO3-+2Cl-。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下图为利用电化学方法处理有机废水的原理示意图。下列说法正确的是

A. a、b极不能使用同种电极材料
B. 工作时,a极的电势低于b极的电势
C. 工作一段时间之后,a极区溶液的pH增大
D. b极的电极反应式为:CH3 COO-+4H2O-8e-=2HCO3-+9H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应,其最终产物的颜色按血红、红褐、淡黄、蓝色顺序排列的是 ①金属钠在氧气中燃烧 ②空气中FeSO4溶液中滴入NaOH溶液 ③FeCl3溶液中滴入KSCN溶液 ④无水硫酸铜放入医用酒精中
A. ②③①④ B. ③②①④ C. ③①②④ D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】闪锌矿的主要成分为ZnS(还含有少量FeS等其他成分),以其为原料冶炼锌的工艺流程如图所示:

(l)闪锌矿焙烧过程中产生的出炉烟气可净化制酸,用于浸出操作。制酸过程中的主要化学方程式为_______。
(2)浸出操作中Fe3+浓度较高,需先加入SO2或ZnS将Fe3+还原为Fe2+,再以ZnO调整溶液酸度,将Fe2+转化成针铁矿( FeOOH)沉淀形成浸出渣。则Fe2+沉淀过程的总化学方程式为_____________。
(3)已知净化操作后的滤液中c(Zn2+)=0.2 mol/L,将该滤液与0.4 mol/L的Na2S溶液等体积混合,充分反应后,混合溶液中c(Zn2+)=_______(ZnS的溶度积帝数Ksp=1. 20×10-23)
(4)净化操作后的滤液加入阴极室内进行电沉积可得到纯锌,原理如右图所示:

①阳极的电极反应式为___________。
②以乙醚(C2H5OC2H5)空气燃料电池为电源电沉积制取纯锌时,阴极室内沉积1.3g锌,理论上乙醚-空气燃料电池消耗____g乙醚。
(5)上述冶炼工艺中的焙烧过程易导致空气污染。采用“氧压酸浸”流程,既可省略焙烧过程又可获得一种非金属单质。“氧压酸浸”流程中发生的主要反应的离子方程式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2,黄绿色易溶于水的气体)是一种安全稳定、高效低毒的消毒剂。工业上通过惰性电极电解氯化铵和盐酸的方法制备,其原理如图所示:
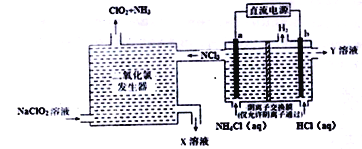
下列说法不正确的是
A. b电极接电源的负极,在b极区流出的Y溶液是稀盐酸
B. 二氧化氯发生器中排出的X溶液中溶质主要为NaCl和NaOH
C. 电解过程中二氧化氯发生器中产生2.24L(标准状况)NH3,则b极产生0.6gH2
D. 电解池a极的电极反应式为NH4+-6e-+4OH-+3Cl-=NCl3+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列说法正确的是
A. 过氧化钠与水反应生成0.1mol氧气时,转移的电子数为0.2NA
B. 常温下,56g铁片投入足量浓H2SO4中生成NA个SO2分子
C. 相同质量的铝,分别与足量的盐酸和氢氧化钠溶液反应放出的氢气体积一定不相同
D. 标准状况下,11.2L N2和O2的混合气体中所含的原子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在蒸发皿中放一小块钠,加热至熔化时,用玻璃棒取少量无水CuSO4与熔化的钠相接触瞬间产生耀眼的火花,同时有红色物质生成。据此判下列说法中不正确的是
A. 上述反应是置换反应
B. 上述反应是放热反应
C. 上述反应中无水CuSO4表现了还原性
D. 加热且无水条件下,钠可以与CuSO4反应并生成Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质相互混合反应后,最终有白色沉淀生成的是
A. 金属钠投入到FeCl3溶液中 B. 明矾溶液和过量NaOH溶液混合
C. 向Na2SiO3溶液中通入足量CO2 D. 氯化钙溶液中通入少量的CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于实验室制备乙烯的实验,下列说法正确的是( )
A.反应物是乙醇和过量的3mol/L硫酸的混合液
B.温度计插入反应液面以下,以便控制温度在140℃
C.反应容器(烧瓶)中应加入少许碎瓷片
D.反应完毕先熄灭酒精灯再从水中取出导管
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com