
【题目】下图为利用电化学方法处理有机废水的原理示意图。下列说法正确的是

A. a、b极不能使用同种电极材料
B. 工作时,a极的电势低于b极的电势
C. 工作一段时间之后,a极区溶液的pH增大
D. b极的电极反应式为:CH3 COO-+4H2O-8e-=2HCO3-+9H+
【答案】D
【解析】
图中连接负载(用电器)的装置为原电池,根据电极上的物质变化,判断得或失电子、电极名称, 写出电极反应式。应用原电池原理是正确判断的关键。
A项:电极a、b上发生的反应不同,因而两极间形成电势差,故电极材料可同可异,A项错误;
B项:工作时,电极b上CH3COO-→HCO3-,碳元素从平均0价失电子升至+4 价,电极b是原电池的负极,则电极a是电池的正极,a极的电势高于b极的电势,B项错误;
C项:电极a(正极)电极反应为![]() +H++2e- →
+H++2e- → ![]() +Cl-,正极每得到2mol电子时,为使溶液电中性,必有2molH+通过质子交换膜进入a极溶液,同时电极反应消耗1molH+。故工作一段时间之后,a极区溶液中H+浓度增大,pH减小,C项错误;
+Cl-,正极每得到2mol电子时,为使溶液电中性,必有2molH+通过质子交换膜进入a极溶液,同时电极反应消耗1molH+。故工作一段时间之后,a极区溶液中H+浓度增大,pH减小,C项错误;
D项:据图中物质转化,考虑到质量守恒和电荷守恒关系,电极b(负极)反应为CH3 COO-+4H2O-8e-=2HCO3-+9H+,D项正确。
本题选D。


科目:高中化学 来源: 题型:
【题目】下图是部分短周期元素化合价与原子序数的关系图,下列说法不正确的是

A. 气态氢化物的稳定性:R>W
B. X与Y可以形成原子个数比为1:1和1:2的两种离子化合物
C. 由X、Y、Z、W、R五种元素形成的简单离子中半径最小的是X2-
D. Y和Z两者最高价氧化物对应的水化物能相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知a、b、c、d四种短周期主族元素,在周期表中相对位置如下图所示,下列说法正确的是( )

A. a、c两元素的最高正价一定相等
B. d的原子序数不可能是b的原子序数的3倍
C. 若c元素最高价氧化物对应的水化物是强酸,则d元素的单质具有强氧化性
D. c的最高价氧化物对应的水化物可溶于d的最高价氧化物对应的水化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生物炼铜实际上是微生物帮助我们从矿石中提取铜。这些“吃岩石的细菌”能利用空气中的氧气将不溶性的CuS转化成可溶性铜的化合物,该化合物是( )
A.碳酸铜B.硝酸铜C.硫酸铜D.氢氧化铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】富马酸(反式丁烯二酸)可用于制备聚酯树脂、医药等。实验室以石油的裂解产物之一A为原料制备富马酸及其衍生物的一种工艺路线如下:
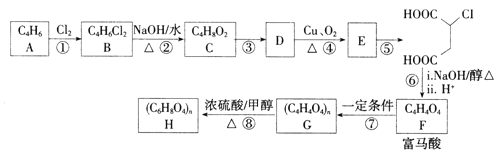
已知:链烃A的核磁共振氢谱中有2组吸收峰。
(1)A的化学名称为________,B的结构简式为__________。
(2)③的反应类型为________.检验E中含氧官能团所用的试剂为___________。
(3)反应④的化学方程式为___________。
(4)反应⑧的化学方程式为______________。
(5)富马酸的同分异构体中,同为二元羧酸的还有__________(包括顺反异构)。
(6)已知: 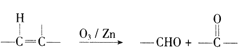 ,参照上述合成路线,以
,参照上述合成路线,以![]() 为原料( 无机试剂任选).设计制备
为原料( 无机试剂任选).设计制备![]() 的合成路线:_____________________。
的合成路线:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化碳与氢气催化合成甲醇,发生的反应为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)

(1)已知:计算上述反应的△H=______________kJ·mol-1。
(2)一定条件下,将n(CO2):n(H2)=1:1的混合气充入恒温恒容密闭容器中,下列事实可以说明该反应已达平衡的是_______________(填选项字母)。
A.容器内气体密度保持不变 B.H2O(g)与CO2(g)的生成速率之比为1∶1
C.容器中压强保持不变 D.该反应的平衡常数保持不变
(3)一定条件下,往2L恒容密闭容器中充入1.2molCO2和3.6molH2,在不同催化剂作用下的反应I、反应II与反应III,相同时间内CO2转化率随温度变化的数据如表所示,据表中数据绘制下右图:

(T5时,图中C点转化率为66.67%,即转化了2/3)
① 催化剂效果最佳的反应是________________(填“反应I”,“反应II”,“反应III”)。
② T3的b点v(正)______v(逆)(填 “>”, “<”, “=” )。
③ T4的a点转化率比T5 的c点高的原因是____________________________。
④ 求温度为T5时,该反应的平衡常数K =_______。要求在答题卡相应空白处写出计算过程(结果保留三位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图如下:

c电极的反应方程式为:__________________________。
(2)有机物C4H10与氯气发生取代反应,生成的一氯代物有_______种。
(3) 已知反应H2(g)+Br2(l)2HBr(g)在25 ℃、101 kPa下进行,放出热量为72 kJ,蒸发1 mol Br2(l)需要吸收的能量为30 kJ,其他相关数据如下表:
H2(g) | Br2(g) | HBr(g) | |
1 mol分子中的化学键断裂时需要吸收的能量/kJ | 436 | a | 369 |
则表中a为(_____________)
(4) 元素周期表中第ⅦA族元素的单质及其化合物的用途广泛。

一定条件,在水溶液中1 mol Cl-、ClOX-(x=1,2,3,4)的能量(KJ)相对大小如上图所示。
①D是__________(填离子符号)。
②B→A+C反应的离子方程式为__________________;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com